题型专练3 工艺流程题
一、刷难关
1.利用硝酸工业的尾气(含 $ {\rm \mathrm{N}\mathrm{O}} $ 、 $ {\rm {\mathrm{N}\mathrm{O}}_{2}} $ )获得 $ {\rm \mathrm{C}\mathrm{a}({\mathrm{N}\mathrm{O}}_{2})_{2}} $ 的部分工艺流程如下:
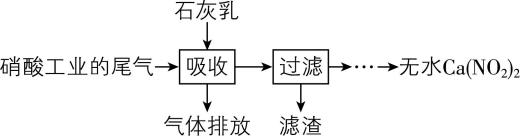
下列说法不正确的是( )
A. 吸收硝酸工业尾气的石灰乳不能用澄清石灰水替换
B. 为使尾气被充分吸收,尾气与石灰乳采用气液逆流接触吸收
C. 若尾气中 $ {\rm n({\mathrm{N}\mathrm{O}}_{2}):n(\mathrm{N}\mathrm{O}) < 1:1} $ , $ {\rm \mathrm{C}\mathrm{a}({\mathrm{N}\mathrm{O}}_{2})_{2}} $ 产品中 $ {\rm \mathrm{C}\mathrm{a}({\mathrm{N}\mathrm{O}}_{3})_{2}} $ 含量升高
D. $ {\rm \mathrm{C}\mathrm{a}({\mathrm{N}\mathrm{O}}_{2})_{2}} $ 在酸性溶液中分解的离子方程式为 $ {\rm 3{\mathrm{N}\mathrm{O}}_{2}^{-}+2{\mathrm{H}}^{+}\xlongequal{}{\mathrm{N}\mathrm{O}}_{3}^{-}+2\mathrm{N}\mathrm{O}↑+{\mathrm{H}}_{2}\mathrm{O}} $
答案:C
解析:吸收硝酸工业尾气的石灰乳不能用澄清石灰水替换,因为 $ {\rm \mathrm{C}\mathrm{a}(\mathrm{O}\mathrm{H})_{2}} $ 在水中溶解度较小,澄清石灰水中溶质太少,不能很好地吸收尾气, $ {\rm \mathrm{A}} $ 正确。尾气与石灰乳采用气液逆流接触吸收,可以增大反应物的接触面积,有利于尾气被充分吸收, $ {\rm \mathrm{B}} $ 正确。若尾气中 $ {\rm n({\mathrm{N}\mathrm{O}}_{2}):n(\mathrm{N}\mathrm{O}) < 1:1} $ ,说明一氧化氮比二氧化氮多,发生反应 $ {\rm \mathrm{N}\mathrm{O}+{\mathrm{N}\mathrm{O}}_{2}+\mathrm{C}\mathrm{a}(\mathrm{O}\mathrm{H})_{2}\xlongequal{}\mathrm{C}\mathrm{a}({\mathrm{N}\mathrm{O}}_{2})_{2}+{\mathrm{H}}_{2}\mathrm{O}} $ ,多余的 $ {\rm \mathrm{N}\mathrm{O}} $ 无法被 $ {\rm \mathrm{C}\mathrm{a}(\mathrm{O}\mathrm{H})_{2}} $ 吸收,造成排放气体中 $ {\rm \mathrm{N}\mathrm{O}} $ 含量升高;若 $ {\rm n({\mathrm{N}\mathrm{O}}_{2}):n(\mathrm{N}\mathrm{O}) > 1:1} $ ,二氧化氮过量,先后发生反应 $ {\rm \mathrm{N}\mathrm{O}+{\mathrm{N}\mathrm{O}}_{2}+\mathrm{C}\mathrm{a}(\mathrm{O}\mathrm{H})_{2}\xlongequal{}\mathrm{C}\mathrm{a}({\mathrm{N}\mathrm{O}}_{2})_{2}+{\mathrm{H}}_{2}\mathrm{O}} $ 、 $ {\rm 4{\mathrm{N}\mathrm{O}}_{2}+2\mathrm{C}\mathrm{a}(\mathrm{O}\mathrm{H})_{2}\xlongequal{}\mathrm{C}\mathrm{a}({\mathrm{N}\mathrm{O}}_{3})_{2}+\mathrm{C}\mathrm{a}({\mathrm{N}\mathrm{O}}_{2})_{2}+2{\mathrm{H}}_{2}\mathrm{O}} $ ,导致 $ {\rm \mathrm{C}\mathrm{a}({\mathrm{N}\mathrm{O}}_{2})_{2}} $ 产品中 $ {\rm \mathrm{C}\mathrm{a}({\mathrm{N}\mathrm{O}}_{3})_{2}} $ 含量升高, $ {\rm \mathrm{C}} $ 错误。 $ {\rm \mathrm{C}\mathrm{a}({\mathrm{N}\mathrm{O}}_{2})_{2}} $ 在酸性溶液中分解,亚硝酸根离子发生自身的氧化还原反应,即歧化反应,离子方程式为 $ {\rm 3{\mathrm{N}\mathrm{O}}_{2}^{-}+2{\mathrm{H}}^{+}\xlongequal{}{\mathrm{N}\mathrm{O}}_{3}^{-}+2\mathrm{N}\mathrm{O}↑+{\mathrm{H}}_{2}\mathrm{O}} $ , $ {\rm \mathrm{D}} $ 正确。
2.海洋中有丰富的水生生物和化学资源。海水晒盐后,以其母液(卤水)和贝壳为原料,还可以生产一种具有特殊用途的材料——纳米氧化镁,其简要流程如下:
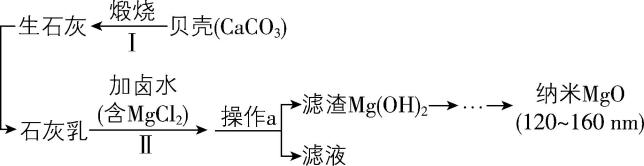
下列说法正确的是( )
A. 步骤Ⅱ中发生反应的离子方程式为 $ {\rm \mathrm{C}\mathrm{a}(\mathrm{O}\mathrm{H})_{2}+{\mathrm{M}\mathrm{g}}^{2+}\xlongequal{}\mathrm{M}\mathrm{g}(\mathrm{O}\mathrm{H})_{2}+{\mathrm{C}\mathrm{a}}^{2+}} $
B. 纳米 $ {\rm \mathrm{M}\mathrm{g}\mathrm{O}} $ 溶于水后形成的分散系可产生丁达尔效应
C. 操作 $ \mathrm{a} $ 为蒸馏
D. 滤液中含有的微粒仅为 $ {\rm {\mathrm{C}\mathrm{a}}^{2+}} $ 和 $ {\rm {\mathrm{C}\mathrm{l}}^{-}} $
答案:A
解析:步骤Ⅱ中,石灰乳 $ {\rm [\mathrm{C}\mathrm{a} (\mathrm{O}\mathrm{H})_{2} ]} $ 和卤水(含 $ {\rm {\mathrm{M}\mathrm{g}\mathrm{C}\mathrm{l}}_{2}} $ )反应生成 $ {\rm \mathrm{M}\mathrm{g}(\mathrm{O}\mathrm{H})_{2}} $ 沉淀和 $ {\rm {\mathrm{C}\mathrm{a}\mathrm{C}\mathrm{l}}_{2}} $ ,反应的离子方程式为 $ {\rm \mathrm{C}\mathrm{a}(\mathrm{O}\mathrm{H})_{2}+{\mathrm{M}\mathrm{g}}^{2+}\xlongequal{}\mathrm{M}\mathrm{g}(\mathrm{O}\mathrm{H})_{2}+{\mathrm{C}\mathrm{a}}^{2+}} $ , $ {\rm \mathrm{A}} $ 正确;由题给信息可知,纳米 $ {\rm \mathrm{M}\mathrm{g}\mathrm{O}} $ 的分散质粒子直径大于 $ 100\mathrm{n}\mathrm{m} $ ,溶于水后形成的分散系不是胶体,不能产生丁达尔效应, $ {\rm \mathrm{B}} $ 错误;操作 $ \mathrm{a} $ 为固液分离的操作,故为过滤, $ {\rm \mathrm{C}} $ 错误;滤液中的微粒主要为 $ {\rm {\mathrm{C}\mathrm{a}}^{2+}} $ 和 $ {\rm {\mathrm{C}\mathrm{l}}^{-}} $ ,还含有少量 $ {\rm {\mathrm{M}\mathrm{g}}^{2+}} $ 等, $ {\rm \mathrm{D}} $ 错误。
3.煤气化渣属于大宗固废,主要成分为 $ {\rm {\mathrm{F}\mathrm{e}}_{2}{\mathrm{O}}_{3}} $ 、 $ {\rm {\mathrm{A}\mathrm{l}}_{2}{\mathrm{O}}_{3}} $ 、 $ {\rm {\mathrm{S}\mathrm{i}\mathrm{O}}_{2}} $ 等。某化学兴趣小组参考真实工艺后设计了以下流程,用来制备钠基正极材料 $ {\rm {\mathrm{N}\mathrm{a}\mathrm{F}\mathrm{e}\mathrm{O}}_{2}} $ 。下列说法不正确的是( )
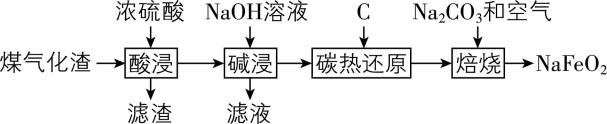
已知:该工艺经“碳热还原”得到 $ {\rm {\mathrm{F}\mathrm{e}}_{3}{\mathrm{O}}_{4}} $ 。
A. “滤渣”的主要成分为 $ {\rm {\mathrm{H}}_{2}{\mathrm{S}\mathrm{i}\mathrm{O}}_{3}} $
B. 实验室模拟“焙烧”过程需要用到坩埚
C. “碱浸”后的“滤液”经一系列操作可回收得到 $ {\rm {\mathrm{A}\mathrm{l}}_{2}{\mathrm{O}}_{3}} $
D. “焙烧”生成 $ {\rm {\mathrm{N}\mathrm{a}\mathrm{F}\mathrm{e}\mathrm{O}}_{2}} $ 的反应化学方程式为 $ {\rm 4{\mathrm{F}\mathrm{e}}_{3}{\mathrm{O}}_{4}+6{\mathrm{N}\mathrm{a}}_{2}{\mathrm{C}\mathrm{O}}_{3}+{\mathrm{O}}_{2}\xlongequal{焙烧}12{\mathrm{N}\mathrm{a}\mathrm{F}\mathrm{e}\mathrm{O}}_{2}+6{\mathrm{C}\mathrm{O}}_{2}} $
答案:A
解析:根据思路导引可知, $ {\rm {\mathrm{S}\mathrm{i}\mathrm{O}}_{2}} $ 和硫酸不反应,“滤渣”的主要成分为 $ {\rm {\mathrm{S}\mathrm{i}\mathrm{O}}_{2}} $ , $ {\rm \mathrm{A}} $ 错误;实验室灼烧固体物质时需在坩埚中进行, $ {\rm \mathrm{B}} $ 正确;“碱浸”后的“滤液”中含有四羟基合铝酸钠,向该滤液中通入过量二氧化碳得到氢氧化铝沉淀,再煅烧可得到 $ {\rm {\mathrm{A}\mathrm{l}}_{2}{\mathrm{O}}_{3}} $ ,故“碱浸”后的“滤液”经一系列操作可回收得到 $ {\rm {\mathrm{A}\mathrm{l}}_{2}{\mathrm{O}}_{3}} $ , $ {\rm \mathrm{C}} $ 正确;“焙烧”时, $ {\rm {\mathrm{F}\mathrm{e}}_{3}{\mathrm{O}}_{4}} $ 和碳酸钠、氧气反应生成 $ {\rm {\mathrm{N}\mathrm{a}\mathrm{F}\mathrm{e}\mathrm{O}}_{2}} $ ,反应的化学方程式为 $ {\rm 4{\mathrm{F}\mathrm{e}}_{3}{\mathrm{O}}_{4}+6{\mathrm{N}\mathrm{a}}_{2}{\mathrm{C}\mathrm{O}}_{3}+{\mathrm{O}}_{2}\xlongequal{焙烧}12{\mathrm{N}\mathrm{a}\mathrm{F}\mathrm{e}\mathrm{O}}_{2}+6{\mathrm{C}\mathrm{O}}_{2}} $ , $ {\rm \mathrm{D}} $ 正确。
4.用高分子吸附树脂提取卤水中的碘(主要以 $ {\rm {\mathrm{I}}^{-}} $ 形式存在)的工艺流程如下:
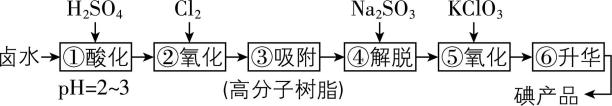
资料:ⅰ.高分子树脂可以选择性吸附溶液中的碘单质。
$ {\rm ⅱ.{\mathrm{S}\mathrm{O}}_{3}^{2-}} $ 中 $ {\rm \mathrm{S}(Ⅳ)} $ 具有较强的还原性,易被氧化为 $ {\rm {\mathrm{S}\mathrm{O}}_{4}^{2-}} $ 。
(1) 步骤②中反应的离子方程式为 。
(2) 用化学用语解释步骤④中 $ {\rm {\mathrm{N}\mathrm{a}}_{2}{\mathrm{S}\mathrm{O}}_{3}} $ 的作用: (填离子方程式)。
(3) 步骤①后所得溶液中 $ {\rm c({\mathrm{I}}^{-})} $ 与步骤④后所得溶液中 $ {\rm c({\mathrm{I}}^{-})} $ 的大小关系是 $ > $ (填序号);步骤①~④的目的是 。
(4) 若②和⑤中分别得到等量的 $ {\rm {\mathrm{I}}_{2}} $ ,则消耗的 $ {\rm n({\mathrm{C}\mathrm{l}}_{2}):n({\mathrm{K}\mathrm{C}\mathrm{l}\mathrm{O}}_{3})=} $ 。
(5) 步骤⑥升华是 (填“物理变化”或“化学变化”)。
答案:(1) $ {\rm 2{\mathrm{I}}^{-}+{\mathrm{C}\mathrm{l}}_{2}\xlongequal{}2{\mathrm{C}\mathrm{l}}^{-}+{\mathrm{I}}_{2}} $
(2) $ {\rm {\mathrm{H}}_{2}\mathrm{O}+{\mathrm{S}\mathrm{O}}_{3}^{2-}+{\mathrm{I}}_{2}\xlongequal{}{\mathrm{S}\mathrm{O}}_{4}^{2-}+2{\mathrm{I}}^{-}+2{\mathrm{H}}^{+}} $ (或 $ {\rm {\mathrm{H}}_{2}\mathrm{O}+3{\mathrm{S}\mathrm{O}}_{3}^{2-}+{\mathrm{I}}_{2}\xlongequal{}{\mathrm{S}\mathrm{O}}_{4}^{2-}+2{\mathrm{I}}^{-}+2{\mathrm{H}\mathrm{S}\mathrm{O}}_{3}^{-}} $ )
(3) ④;①;富集 $ {\rm {\mathrm{I}}^{-}} $
(4) $ 3:1 $
(5) 物理变化
解析:(1) 步骤②中, $ {\rm {\mathrm{I}}^{-}} $ 被氯气氧化生成 $ {\rm {\mathrm{I}}_{2}} $ ,反应的离子方程式为 $ {\rm 2{\mathrm{I}}^{-}+{\mathrm{C}\mathrm{l}}_{2}\xlongequal{}2{\mathrm{C}\mathrm{l}}^{-}+{\mathrm{I}}_{2}} $ 。
(2) 步骤④加入亚硫酸钠是为了将吸附在高分子树脂上的 $ {\rm {\mathrm{I}}_{2}} $ 还原成 $ {\rm {\mathrm{I}}^{-}} $ ,从而脱离高分子树脂,相应的离子方程式为 $ {\rm {\mathrm{H}}_{2}\mathrm{O}+{\mathrm{S}\mathrm{O}}_{3}^{2-}+{\mathrm{I}}_{2}\xlongequal{}{\mathrm{S}\mathrm{O}}_{4}^{2-}+2{\mathrm{I}}^{-}+2{\mathrm{H}}^{+}} $ 或 $ {\rm {\mathrm{H}}_{2}\mathrm{O}+3{\mathrm{S}\mathrm{O}}_{3}^{2-}+{\mathrm{I}}_{2}\xlongequal{}{\mathrm{S}\mathrm{O}}_{4}^{2-}+2{\mathrm{I}}^{-}+2{\mathrm{H}\mathrm{S}\mathrm{O}}_{3}^{-}} $ 。
(3) 由分析可知,步骤③中碘得以富集,故 $ {\rm {\mathrm{I}}^{-}} $ 的浓度: $ ④ > ① $ 。
(4) 根据反应 $ {\rm ②{\mathrm{C}\mathrm{l}}_{2}+2{\mathrm{I}}^{-}\xlongequal{}2{\mathrm{C}\mathrm{l}}^{-}+{\mathrm{I}}_{2}} $ 和 $ {\rm ⑤{\mathrm{C}\mathrm{l}\mathrm{O}}_{3}^{-}+6{\mathrm{I}}^{-}+6{\mathrm{H}}^{+}\xlongequal{}3{\mathrm{I}}_{2}+{\mathrm{C}\mathrm{l}}^{-}+3{\mathrm{H}}_{2}\mathrm{O}} $ 可得如下计量关系: $ {\rm 3{\mathrm{C}\mathrm{l}}_{2}\sim 3{\mathrm{I}}_{2}\sim {\mathrm{C}\mathrm{l}\mathrm{O}}_{3}^{-}} $ ,故②和⑤分别得到等量的 $ {\rm {\mathrm{I}}_{2}} $ 时,消耗的 $ {\rm n({\mathrm{C}\mathrm{l}}_{2}):n({\mathrm{K}\mathrm{C}\mathrm{l}\mathrm{O}}_{3})=3:1} $ 。
(5) 碘的升华过程中,只是碘的状态发生了改变,并没有发生化学键的断裂和形成,属于物理变化。
5.以铍精矿(主要成分为铍、铝、硅、铁的氧化物和碳酸钙)为原料制备氢氧化铍的工艺流程如下所示。
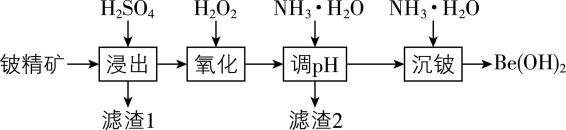
已知: $ {\rm ①\mathrm{B}\mathrm{e}(\mathrm{O}\mathrm{H})_{2}} $ 与 $ {\rm \mathrm{A}\mathrm{l}(\mathrm{O}\mathrm{H})_{3}} $ 具有相似的化学性质;
②几种金属离子生成氢氧化物沉淀时的 $ {\rm \mathrm{p}\mathrm{H}} $ 如表所示。
金属离子 | $ {\rm {\mathrm{F}\mathrm{e}}^{2+}} $ | $ {\rm {\mathrm{F}\mathrm{e}}^{3+}} $ | $ {\rm {\mathrm{A}\mathrm{l}}^{3+}} $ | $ {\rm {\mathrm{B}\mathrm{e}}^{2+}} $ |
开始沉淀的 $ {\rm \mathrm{p}\mathrm{H}} $ | 8.0 | 2.7 | 3.3 | 5.2 |
完全沉淀的 $ {\rm \mathrm{p}\mathrm{H}} $ | 9.6 | 3.7 | 4.9 | 8.8 |
回答下列问题:
(1) “浸出”前粉碎铍精矿的目的是 ;滤渣1的主要成分为 (填化学式)。
(2) “氧化”时发生反应的离子方程式为 ; $ {\rm {\mathrm{H}}_{2}{\mathrm{O}}_{2}} $ 的实际用量远大于理论用量,可能的原因是 。
(3) “调 $ {\rm \mathrm{p}\mathrm{H}} $ ”的范围是 。
(4) “沉铍”时发生反应的离子方程式为 ,判断 $ {\rm {\mathrm{B}\mathrm{e}}^{2+}} $ 已经沉淀完全的实验操作是 。
答案:(1) 增大浸出时反应物接触面积,加快浸出速率(合理即可); $ {\rm {\mathrm{S}\mathrm{i}\mathrm{O}}_{2}} $ 、 $ {\rm {\mathrm{C}\mathrm{a}\mathrm{S}\mathrm{O}}_{4}} $
(2) $ {\rm {\mathrm{H}}_{2}{\mathrm{O}}_{2}+2{\mathrm{F}\mathrm{e}}^{2+}+2{\mathrm{H}}^{+}\xlongequal{}2{\mathrm{F}\mathrm{e}}^{3+}+2{\mathrm{H}}_{2}\mathrm{O}} $ ; $ {\rm {\mathrm{F}\mathrm{e}}^{3+}} $ 催化 $ {\rm {\mathrm{H}}_{2}{\mathrm{O}}_{2}} $ 分解
(3) $ {\rm 4.9⩽ \mathrm{p}\mathrm{H} < 5.2} $
(4) $ {\rm {\mathrm{B}\mathrm{e}}^{2+}+2{\mathrm{N}\mathrm{H}}_{3}\cdot {\mathrm{H}}_{2}\mathrm{O}\xlongequal{}\mathrm{B}\mathrm{e}(\mathrm{O}\mathrm{H})_{2}↓+2{\mathrm{N}\mathrm{H}}_{4}^{+}} $ ;静置,向上层清液中继续滴加氨水,若无沉淀生成,证明 $ {\rm {\mathrm{B}\mathrm{e}}^{2+}} $ 已经沉淀完全
解析:(1) “浸出”前粉碎铍精矿可增大浸出时反应物接触面积,加快浸出速率;滤渣1的主要成分为 $ {\rm {\mathrm{S}\mathrm{i}\mathrm{O}}_{2}} $ 、 $ {\rm {\mathrm{C}\mathrm{a}\mathrm{S}\mathrm{O}}_{4}} $ 。
(2) $ {\rm {\mathrm{H}}_{2}{\mathrm{O}}_{2}} $ 将 $ {\rm {\mathrm{F}\mathrm{e}}^{2+}} $ 氧化为 $ {\rm {\mathrm{F}\mathrm{e}}^{3+}} $ ,离子方程式为 $ {\rm {\mathrm{H}}_{2}{\mathrm{O}}_{2}+2{\mathrm{F}\mathrm{e}}^{2+}+2{\mathrm{H}}^{+}\xlongequal{}2{\mathrm{F}\mathrm{e}}^{3+}+2{\mathrm{H}}_{2}\mathrm{O}} $ ; $ {\rm {\mathrm{F}\mathrm{e}}^{3+}} $ 能催化 $ {\rm {\mathrm{H}}_{2}{\mathrm{O}}_{2}} $ 分解,则 $ {\rm {\mathrm{H}}_{2}{\mathrm{O}}_{2}} $ 的实际用量远大于理论用量。
(3) “调 $ {\rm \mathrm{p}\mathrm{H}} $ ”的目的是将 $ {\rm {\mathrm{F}\mathrm{e}}^{3+}} $ 、 $ {\rm {\mathrm{A}\mathrm{l}}^{3+}} $ 沉淀完全而 $ {\rm {\mathrm{B}\mathrm{e}}^{2+}} $ 不沉淀,则 $ {\rm \mathrm{p}\mathrm{H}} $ 的范围是 $ {\rm 4.9⩽ \mathrm{p}\mathrm{H} < 5.2} $ 。
(4) “沉铍”时发生反应的离子方程式为 $ {\rm {\mathrm{B}\mathrm{e}}^{2+}+2{\mathrm{N}\mathrm{H}}_{3}\cdot {\mathrm{H}}_{2}\mathrm{O}\xlongequal{}\mathrm{B}\mathrm{e}(\mathrm{O}\mathrm{H})_{2}↓+2{\mathrm{N}\mathrm{H}}_{4}^{+}} $ ;可通过向静置后的上层清液中继续滴加氨水,观察有无沉淀生成来判断 $ {\rm {\mathrm{B}\mathrm{e}}^{2+}} $ 是否已经沉淀完全。
6.以某混合氧化物(由 $ {\rm {\mathrm{M}\mathrm{n}\mathrm{O}}_{2}} $ 、 $ {\rm \mathrm{Z}\mathrm{n}\mathrm{O}} $ 、 $ {\rm \mathrm{C}\mathrm{u}\mathrm{O}} $ 、 $ {\rm {\mathrm{F}\mathrm{e}}_{2}{\mathrm{O}}_{3}} $ 组成)为原料制备 $ {\rm {\mathrm{K}\mathrm{M}\mathrm{n}\mathrm{O}}_{4}} $ 和 $ {\rm {\mathrm{F}\mathrm{e}\mathrm{S}\mathrm{O}}_{4}\cdot 7{\mathrm{H}}_{2}\mathrm{O}} $ 的工艺流程如下:
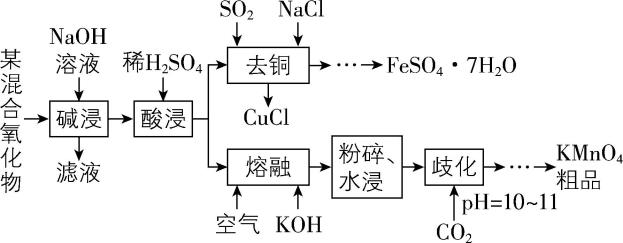
已知: $ {\rm \mathrm{Z}\mathrm{n}\mathrm{O}} $ 与 $ {\rm {\mathrm{A}\mathrm{l}}_{2}{\mathrm{O}}_{3}} $ 的化学性质相似。
回答下列问题:
(1) 写出“碱浸”时, $ {\rm \mathrm{Z}\mathrm{n}\mathrm{O}} $ 反应的化学方程式: 。
(2) “去铜”时,生成 $ {\rm \mathrm{C}\mathrm{u}\mathrm{C}\mathrm{l}} $ 的离子方程式为 。
(3) 检验“去铜”后溶液是否含有 $ {\rm {\mathrm{F}\mathrm{e}}^{3+}} $ 的操作和现象是 。
(4) “熔融”时 $ {\rm {\mathrm{M}\mathrm{n}\mathrm{O}}_{2}} $ 转化为 $ {\rm {\mathrm{K}}_{2}{\mathrm{M}\mathrm{n}\mathrm{O}}_{4}} $ ,该反应中每转移 $ 1\mathrm{m}\mathrm{o}\mathrm{l} $ 电子,消耗 $ {\rm \mathrm{g}{\mathrm{M}\mathrm{n}\mathrm{O}}_{2}} $ 。
(5) 已知“歧化”时反应为 $ {\rm 3{\mathrm{K}}_{2}{\mathrm{M}\mathrm{n}\mathrm{O}}_{4}+2{\mathrm{C}\mathrm{O}}_{2}\xlongequal{}2{\mathrm{K}\mathrm{M}\mathrm{n}\mathrm{O}}_{4}+{\mathrm{M}\mathrm{n}\mathrm{O}}_{2}↓+2{\mathrm{K}}_{2}{\mathrm{C}\mathrm{O}}_{3}} $ 。常温下,相关物质的溶解度数据如表所示。
物质 | $ {\rm {\mathrm{K}}_{2}{\mathrm{C}\mathrm{O}}_{3}} $ | $ {\rm {\mathrm{K}\mathrm{H}\mathrm{C}\mathrm{O}}_{3}} $ | $ {\rm {\mathrm{K}}_{2}{\mathrm{S}\mathrm{O}}_{4}} $ | $ {\rm {\mathrm{K}\mathrm{M}\mathrm{n}\mathrm{O}}_{4}} $ | $ {\rm {\mathrm{C}\mathrm{H}}_{3}\mathrm{C}\mathrm{O}\mathrm{O}\mathrm{K}} $ | $ {\rm \mathrm{K}\mathrm{C}\mathrm{l}} $ |
溶解度 $ (\mathrm{g}/100\mathrm{g} $ 水 $ ) $ | 111 | 33.7 | 11.1 | 6.34 | 256 | 34.2 |
通入 $ {\rm {\mathrm{C}\mathrm{O}}_{2}} $ 至溶液 $ {\rm \mathrm{p}\mathrm{H}} $ 达 $ 10\sim 11 $ 时,应停止通 $ {\rm {\mathrm{C}\mathrm{O}}_{2}} $ ,不能继续通入 $ {\rm {\mathrm{C}\mathrm{O}}_{2}} $ 的原因是 。可以替代 $ {\rm {\mathrm{C}\mathrm{O}}_{2}} $ 的试剂是 (填“稀盐酸”“稀硫酸”或“稀醋酸”)。
(6) $ {\rm {\mathrm{K}\mathrm{M}\mathrm{n}\mathrm{O}}_{4}} $ 的纯度测定:称取 $ {\rm m\mathrm{g}{\mathrm{K}\mathrm{M}\mathrm{n}\mathrm{O}}_{4}} $ 粗品于烧杯中,加入蒸馏水和稀硫酸溶解,再用 $ {\rm 0.5\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}} $ 的 $ {\rm {\mathrm{N}\mathrm{a}}_{2}{\mathrm{C}}_{2}{\mathrm{O}}_{4}} $ 溶液与之反应,消耗 $ {\rm {\mathrm{N}\mathrm{a}}_{2}{\mathrm{C}}_{2}{\mathrm{O}}_{4}} $ 溶液 $ {\rm 20.00\mathrm{m}\mathrm{L}} $ 。 $ {\rm {\mathrm{K}\mathrm{M}\mathrm{n}\mathrm{O}}_{4}} $ 样品的纯度为 $ \% $ (用含 $ m $ 的代数式表示,杂质不参与反应,已知酸性条件下 $ {\rm {\mathrm{K}\mathrm{M}\mathrm{n}\mathrm{O}}_{4}} $ 与 $ {\rm {\mathrm{N}\mathrm{a}}_{2}{\mathrm{C}}_{2}{\mathrm{O}}_{4}} $ 反应,生成 $ {\rm {\mathrm{M}\mathrm{n}}^{2+}} $ 和 $ {\rm {\mathrm{C}\mathrm{O}}_{2}} $ )。
答案:(1) $ {\rm \mathrm{Z}\mathrm{n}\mathrm{O}+2\mathrm{N}\mathrm{a}\mathrm{O}\mathrm{H}+{\mathrm{H}}_{2}\mathrm{O}\xlongequal{}{\mathrm{N}\mathrm{a}}_{2} [\mathrm{Z}\mathrm{n} (\mathrm{O}\mathrm{H})_{4} ]} $
(2) $ {\rm 2{\mathrm{C}\mathrm{u}}^{2+}+2{\mathrm{C}\mathrm{l}}^{-}+{\mathrm{S}\mathrm{O}}_{2}+2{\mathrm{H}}_{2}\mathrm{O}\xlongequal{}2\mathrm{C}\mathrm{u}\mathrm{C}\mathrm{l}↓+{\mathrm{S}\mathrm{O}}_{4}^{2-}+4{\mathrm{H}}^{+}} $
(3) 取少量上层清液于试管中,加入几滴 $ {\rm \mathrm{K}\mathrm{S}\mathrm{C}\mathrm{N}} $ 溶液,溶液变为红色,则含有 $ {\rm {\mathrm{F}\mathrm{e}}^{3+}} $ ,反之则无
(4) 43.5
(5) 若继续通入 $ {\rm {\mathrm{C}\mathrm{O}}_{2}} $ ,则会生成 $ {\rm {\mathrm{K}\mathrm{H}\mathrm{C}\mathrm{O}}_{3}} $ ,与碳酸钾相比,碳酸氢钾溶解度与高锰酸钾溶解度相差不是很大,会使得到的高锰酸钾粗品中含有较多的 $ {\rm {\mathrm{K}\mathrm{H}\mathrm{C}\mathrm{O}}_{3}} $ 杂质;稀醋酸
(6) $ \dfrac{63.2}{m} $
解析:(1) 已知 $ {\rm \mathrm{Z}\mathrm{n}\mathrm{O}} $ 与 $ {\rm {\mathrm{A}\mathrm{l}}_{2}{\mathrm{O}}_{3}} $ 的性质相似,则 $ {\rm \mathrm{Z}\mathrm{n}\mathrm{O}} $ 可与碱反应生成盐,则“碱浸”时氧化锌和氢氧化钠溶液反应生成四羟基合锌酸钠,化学方程式为 $ {\rm \mathrm{Z}\mathrm{n}\mathrm{O}+2\mathrm{N}\mathrm{a}\mathrm{O}\mathrm{H}+{\mathrm{H}}_{2}\mathrm{O}\xlongequal{}{\mathrm{N}\mathrm{a}}_{2} [\mathrm{Z}\mathrm{n} (\mathrm{O}\mathrm{H})_{4} ]} $ 。
(2) 二氧化硫具有还原性,“去铜”时,二氧化硫将二价铜还原为一价铜,本身被氧化为 $ {\rm {\mathrm{S}\mathrm{O}}_{4}^{2-}} $ ,生成 $ {\rm \mathrm{C}\mathrm{u}\mathrm{C}\mathrm{l}} $ 和 $ {\rm {\mathrm{S}\mathrm{O}}_{4}^{2-}} $ ,根据得失电子守恒、电荷守恒及原子守恒得反应的离子方程式: $ {\rm 2{\mathrm{C}\mathrm{u}}^{2+}+2{\mathrm{C}\mathrm{l}}^{-}+{\mathrm{S}\mathrm{O}}_{2}+2{\mathrm{H}}_{2}\mathrm{O}\xlongequal{}2\mathrm{C}\mathrm{u}\mathrm{C}\mathrm{l}↓+{\mathrm{S}\mathrm{O}}_{4}^{2-}+4{\mathrm{H}}^{+}} $ 。
(4) “熔融”时 $ {\rm {\mathrm{M}\mathrm{n}\mathrm{O}}_{2}} $ 在碱性条件下被空气中的氧气氧化生成 $ {\rm {\mathrm{K}}_{2}{\mathrm{M}\mathrm{n}\mathrm{O}}_{4}} $ ,反应为 $ {\rm 2{\mathrm{M}\mathrm{n}\mathrm{O}}_{2}+{\mathrm{O}}_{2}+4\mathrm{K}\mathrm{O}\mathrm{H}\xlongequal{熔融}2{\mathrm{K}}_{2}{\mathrm{M}\mathrm{n}\mathrm{O}}_{4}+2{\mathrm{H}}_{2}\mathrm{O}} $ ,该反应中每转移 $ 1\mathrm{m}\mathrm{o}\mathrm{l} $ 电子,消耗 $ {\rm 0.5\mathrm{m}\mathrm{o}\mathrm{l}{\mathrm{M}\mathrm{n}\mathrm{O}}_{2}} $ ,质量为 $ 43.5\mathrm{g} $ 。
(5) 可以替代 $ {\rm {\mathrm{C}\mathrm{O}}_{2}} $ 的试剂应选稀醋酸,醋酸钾的溶解度远超过 $ {\rm {\mathrm{K}\mathrm{M}\mathrm{n}\mathrm{O}}_{4}} $ ,而 $ {\rm {\mathrm{K}}_{2}{\mathrm{S}\mathrm{O}}_{4}} $ 、 $ {\rm \mathrm{K}\mathrm{C}\mathrm{l}} $ 溶解度与 $ {\rm {\mathrm{K}\mathrm{M}\mathrm{n}\mathrm{O}}_{4}} $ 相差较少,容易与 $ {\rm {\mathrm{K}\mathrm{M}\mathrm{n}\mathrm{O}}_{4}} $ 一起析出,且弱酸便于控制溶液的 $ {\rm \mathrm{p}\mathrm{H}} $ 。
(6) 已知酸性条件下 $ {\rm {\mathrm{K}\mathrm{M}\mathrm{n}\mathrm{O}}_{4}} $ 与 $ {\rm {\mathrm{N}\mathrm{a}}_{2}{\mathrm{C}}_{2}{\mathrm{O}}_{4}} $ 反应,生成 $ {\rm {\mathrm{M}\mathrm{n}}^{2+}} $ 和 $ {\rm {\mathrm{C}\mathrm{O}}_{2}} $ ,反应中锰元素化合价由 $ +7 $ 变为 $ +2 $ 、碳元素化合价由 $ +3 $ 变为 $ +4 $ ,根据得失电子守恒可得关系式: $ {\rm 2{\mathrm{K}\mathrm{M}\mathrm{n}\mathrm{O}}_{4}\sim 5{\mathrm{N}\mathrm{a}}_{2}{\mathrm{C}}_{2}{\mathrm{O}}_{4}} $ , $ {\rm n({\mathrm{N}\mathrm{a}}_{2}{\mathrm{C}}_{2}{\mathrm{O}}_{4})=0.5\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}×0.02\mathrm{L}=0.01\mathrm{m}\mathrm{o}\mathrm{l}} $ ,则 $ {\rm n({\mathrm{K}\mathrm{M}\mathrm{n}\mathrm{O}}_{4})=\dfrac{2}{5}n({\mathrm{N}\mathrm{a}}_{2}{\mathrm{C}}_{2}{\mathrm{O}}_{4})=\dfrac{2}{5}×0.01\mathrm{m}\mathrm{o}\mathrm{l}=0.004\mathrm{m}\mathrm{o}\mathrm{l}} $ , $ {\rm {\mathrm{K}\mathrm{M}\mathrm{n}\mathrm{O}}_{4}} $ 样品的纯度为 $ \dfrac{0.004\mathrm{m}\mathrm{o}\mathrm{l}×158\mathrm{g}\cdot {\mathrm{m}\mathrm{o}\mathrm{l}}^{-1}}{m\mathrm{g}}×100\%=\dfrac{63.2}{m}\% $ 。
7.利用绿柱石(主要化学成分为 $ {\rm \mathrm{B}\mathrm{e}\mathrm{O}} $ 、 $ {\rm {\mathrm{A}\mathrm{l}}_{2}{\mathrm{O}}_{3}} $ 、 $ {\rm {\mathrm{S}\mathrm{i}\mathrm{O}}_{2}} $ ,还含有少量 $ {\rm \mathrm{F}\mathrm{e}\mathrm{O}} $ 和 $ {\rm {\mathrm{F}\mathrm{e}}_{2}{\mathrm{O}}_{3}} $ )冶炼 $ {\rm \mathrm{B}\mathrm{e}} $ 的一种工艺流程如下。
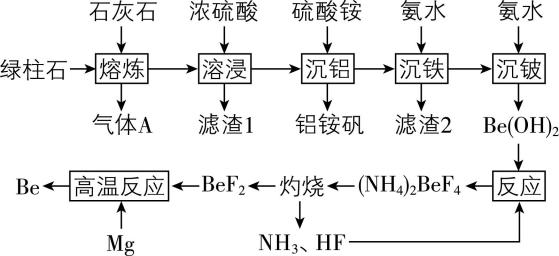
已知:①铍的性质与和铍处于元素周期表对角线位置的铝相似。
②氯化铍在熔融态时较难电离。
③在强碱性条件下, $ {\rm \mathrm{B}\mathrm{e}} $ 元素以 $ {\rm [\mathrm{B}\mathrm{e} (\mathrm{O}\mathrm{H})_{4}{ ]}^{2-}} $ 形式存在。
(1) “熔炼”过程中 $ {\rm {\mathrm{S}\mathrm{i}\mathrm{O}}_{2}} $ 发生的反应化学方程式为 。
(2) 滤渣1的成分为 ;将“溶浸”“沉铁”工序所加试剂改为稀硫酸、过氧化氢和氨水会更好,这是由于 。
(3) “沉铁”时加入氨水将 $ {\rm \mathrm{p}\mathrm{H}} $ 控制在4左右的原因: 。
(4) “沉铍”时若使用 $ {\rm \mathrm{N}\mathrm{a}\mathrm{O}\mathrm{H}} $ 溶液,将导致铍的产率降低,用离子方程式解释原因: 。
(5) 氯化铍熔融盐电解法也可以制备铍,但在电解过程中需要加入一定量 $ {\rm \mathrm{N}\mathrm{a}\mathrm{C}\mathrm{l}} $ ,加入 $ {\rm \mathrm{N}\mathrm{a}\mathrm{C}\mathrm{l}} $ 的作用是 。
(6) 该流程中能循环使用的物质有 $ {\rm \mathrm{H}\mathrm{F}} $ 、 $ {\rm {\mathrm{N}\mathrm{H}}_{3}} $ 和 (填化学式)。
答案:(1) $ {\rm {\mathrm{S}\mathrm{i}\mathrm{O}}_{2}+{\mathrm{C}\mathrm{a}\mathrm{C}\mathrm{O}}_{3}\xlongequal{熔炼}{\mathrm{C}\mathrm{a}\mathrm{S}\mathrm{i}\mathrm{O}}_{3}+{\mathrm{C}\mathrm{O}}_{2}↑} $
(2) $ {\rm {\mathrm{H}}_{2}{\mathrm{S}\mathrm{i}\mathrm{O}}_{3}} $ 、 $ {\rm {\mathrm{C}\mathrm{a}\mathrm{S}\mathrm{O}}_{4}} $ ;浓硫酸和 $ {\rm \mathrm{F}\mathrm{e}\mathrm{O}} $ 发生反应生成的 $ {\rm {\mathrm{S}\mathrm{O}}_{2}} $ 气体有毒且污染空气
(3) $ {\rm \mathrm{p}\mathrm{H}} $ 过低 $ {\rm {\mathrm{F}\mathrm{e}}^{3+}} $ 沉淀不完全,在“沉铍”工序中与 $ {\rm \mathrm{B}\mathrm{e}} $ 元素均形成沉淀,得到的 $ {\rm \mathrm{B}\mathrm{e}(\mathrm{O}\mathrm{H})_{2}} $ 不纯; $ {\rm \mathrm{p}\mathrm{H}} $ 过高 $ {\rm {\mathrm{B}\mathrm{e}}^{2+}} $ 也沉淀, $ {\rm \mathrm{B}\mathrm{e}} $ 产率降低
(4) $ {\rm {\mathrm{B}\mathrm{e}}^{2+}+4{\mathrm{O}\mathrm{H}}^{-}\xlongequal{} [\mathrm{B}\mathrm{e} (\mathrm{O}\mathrm{H})_{4}{ ]}^{2-}} $
(5) 增强熔融盐导电性
(6) $ {\rm ({\mathrm{N}\mathrm{H}}_{4})_{2}{\mathrm{S}\mathrm{O}}_{4}} $
解析:(1) “熔炼”过程中 $ {\rm {\mathrm{S}\mathrm{i}\mathrm{O}}_{2}} $ 与 $ {\rm {\mathrm{C}\mathrm{a}\mathrm{C}\mathrm{O}}_{3}} $ 反应生成 $ {\rm {\mathrm{C}\mathrm{a}\mathrm{S}\mathrm{i}\mathrm{O}}_{3}} $ 和 $ {\rm {\mathrm{C}\mathrm{O}}_{2}} $ ,反应的化学方程式为 $ {\rm {\mathrm{S}\mathrm{i}\mathrm{O}}_{2}+{\mathrm{C}\mathrm{a}\mathrm{C}\mathrm{O}}_{3}\xlongequal{熔炼}{\mathrm{C}\mathrm{a}\mathrm{S}\mathrm{i}\mathrm{O}}_{3}+{\mathrm{C}\mathrm{O}}_{2}↑} $ 。
(2) 根据分析可知,滤渣1的成分为 $ {\rm {\mathrm{H}}_{2}{\mathrm{S}\mathrm{i}\mathrm{O}}_{3}} $ 、 $ {\rm {\mathrm{C}\mathrm{a}\mathrm{S}\mathrm{O}}_{4}} $ ;将“溶浸”“沉铁”工序所加试剂改为稀硫酸、过氧化氢和氨水会更好,这是由于浓硫酸和 $ {\rm \mathrm{F}\mathrm{e}\mathrm{O}} $ 发生氧化还原反应生成的 $ {\rm {\mathrm{S}\mathrm{O}}_{2}} $ 气体有毒且污染空气。
(3) “沉铁”时加入氨水将 $ {\rm \mathrm{p}\mathrm{H}} $ 控制在4左右的原因是 $ {\rm \mathrm{p}\mathrm{H}} $ 过低 $ {\rm {\mathrm{F}\mathrm{e}}^{3+}} $ 沉淀不完全,在“沉铍”工序中与 $ {\rm \mathrm{B}\mathrm{e}} $ 元素均形成沉淀,得到的 $ {\rm \mathrm{B}\mathrm{e}(\mathrm{O}\mathrm{H})_{2}} $ 不纯; $ {\rm \mathrm{p}\mathrm{H}} $ 过高 $ {\rm {\mathrm{B}\mathrm{e}}^{2+}} $ 也沉淀, $ {\rm \mathrm{B}\mathrm{e}} $ 产率降低。
(4) 在强碱性条件下, $ {\rm \mathrm{B}\mathrm{e}} $ 元素以 $ {\rm [\mathrm{B}\mathrm{e} (\mathrm{O}\mathrm{H})_{4}{ ]}^{2-}} $ 形式存在,“沉铍”时,若使用 $ {\rm \mathrm{N}\mathrm{a}\mathrm{O}\mathrm{H}} $ 溶液,将导致铍的产率降低,反应的离子方程式为 $ {\rm {\mathrm{B}\mathrm{e}}^{2+}+4{\mathrm{O}\mathrm{H}}^{-}\xlongequal{} [\mathrm{B}\mathrm{e} (\mathrm{O}\mathrm{H})_{4}{ ]}^{2-}} $ 。
(5) 氯化铍在熔融态时较难电离,故电解过程中加入一定量 $ {\rm \mathrm{N}\mathrm{a}\mathrm{C}\mathrm{l}} $ 的作用是增强熔融盐导电性,提高电解效率。
(6) 根据元素守恒可知,“沉铍”后的滤液中含有 $ {\rm ({\mathrm{N}\mathrm{H}}_{4})_{2}{\mathrm{S}\mathrm{O}}_{4}} $ ,可在“沉铝”工序中利用,灼烧过程中会产生 $ {\rm \mathrm{H}\mathrm{F}} $ 和 $ {\rm {\mathrm{N}\mathrm{H}}_{3}} $ ,可在“反应”工序中利用,故该流程中能循环使用的物质是 $ {\rm ({\mathrm{N}\mathrm{H}}_{4})_{2}{\mathrm{S}\mathrm{O}}_{4}} $ 、 $ {\rm \mathrm{H}\mathrm{F}} $ 、 $ {\rm {\mathrm{N}\mathrm{H}}_{3}} $ 。






