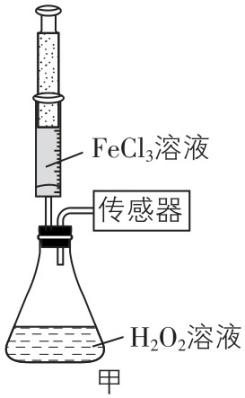
1.某兴趣小组在实验室利用压强传感器探究 $ {\rm {\mathrm{F}\mathrm{e}\mathrm{C}\mathrm{l}}_{3}} $ 催化 $ {\rm {\mathrm{H}}_{2}{\mathrm{O}}_{2}} $ 分解的影响因素。
Ⅰ.实验准备
(1) 配制 $ {\rm 50\mathrm{m}\mathrm{L}1\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}{\mathrm{F}\mathrm{e}\mathrm{C}\mathrm{l}}_{3}} $ 溶液:
① 需称量 $ {\rm {\mathrm{F}\mathrm{e}\mathrm{C}\mathrm{l}}_{3}\cdot 6{\mathrm{H}}_{2}\mathrm{O}} $ (相对分子质量为 $ 270.5 $ )固体的质量为 $ \mathrm{g} $ (结果保留1位小数)。
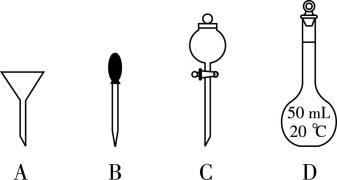
② 该过程中需要用到的玻璃仪器除烧杯、玻璃棒外,还有 (填序号)。
Ⅱ.实验探究
(2) 设计以下实验:
实验编号 | $ {\rm 10{\mathrm{m}\mathrm{L}\mathrm{H}}_{2}{\mathrm{O}}_{2}} $ 溶液 | $ {\rm 1\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}{\mathrm{F}\mathrm{e}\mathrm{C}\mathrm{l}}_{3}} $ 溶液体积/ $ {\rm \mathrm{m}\mathrm{L}} $ | 蒸馏水体积/ $ {\rm \mathrm{m}\mathrm{L}} $ | $ 60\mathrm{s} $ 时气压/ $ {\rm \mathrm{k}\mathrm{P}\mathrm{a}} $ |
1 | $ 15\% $ | 1 | 0 | $ a $ |
2 | $ 10\% $ | 1 | 0 | $ b $ |
3 | $ 5\% $ | 1 | 0 | 126 |
4 | $ 5\% $ | 0.5 | 0.5 | 114 |
① 依据 $ 60\mathrm{s} $ 时容器气压关系: (用 $ a $ 、 $ b $ 及相关数据表示),得到 $ {\rm {\mathrm{H}}_{2}{\mathrm{O}}_{2}} $ 溶液浓度越大,反应速率越快的结论。
② 依据实验 和 (填实验编号),得出结论:催化剂浓度越大,催化的能力越强。
(3) 探究酸性对 $ {\rm {\mathrm{F}\mathrm{e}\mathrm{C}\mathrm{l}}_{3}} $ 催化 $ {\rm {\mathrm{H}}_{2}{\mathrm{O}}_{2}} $ 分解的反应速率的影响。
将 $ {\rm 5\%{\mathrm{H}}_{2}{\mathrm{O}}_{2}} $ 溶液调节为不同 $ {\rm \mathrm{p}\mathrm{H}} $ ,再分别滴入 $ {\rm 1\mathrm{m}\mathrm{L}1\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}{\mathrm{F}\mathrm{e}\mathrm{C}\mathrm{l}}_{3}} $ 溶液,采集数据如图乙所示:
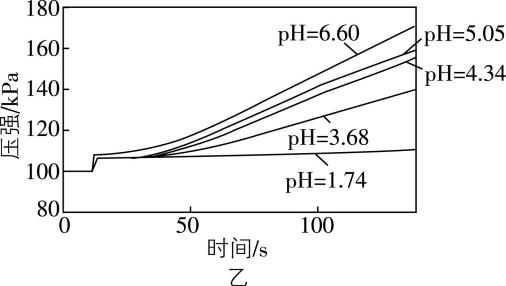
得出结论:其他条件不变,溶液酸性越强, 。
(4) 小组同学进一步探究催化剂对 $ {\rm {\mathrm{H}}_{2}{\mathrm{O}}_{2}} $ 分解速率的影响。
①初步实验:分别取 $ {\rm 10\mathrm{m}\mathrm{L}5\%{\mathrm{H}}_{2}{\mathrm{O}}_{2}} $ 溶液于3只容积相同的锥形瓶中,调节溶液的 $ {\rm \mathrm{p}\mathrm{H}} $ 为5,然后用注射器分别加入 $ {\rm 1\mathrm{m}\mathrm{L}1\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}{\mathrm{F}\mathrm{e}\mathrm{C}\mathrm{l}}_{3}} $ 溶液、 $ {\rm 1\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}{\mathrm{C}\mathrm{u}\mathrm{C}\mathrm{l}}_{2}} $ 溶液和 $ {\rm 1\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}{\mathrm{C}\mathrm{u}\mathrm{S}\mathrm{O}}_{4}} $ 溶液,采集数据,并重复进行平行实验3次,取最佳的实验数据曲线如图丙所示:
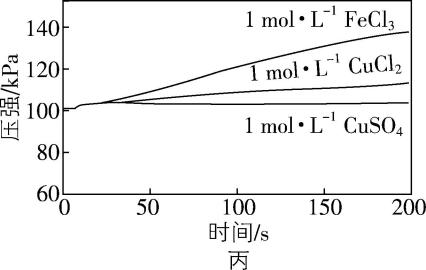
② 分析讨论:小组同学根据实验结果得出如下推论。
推论 $ {\rm 1:{\mathrm{C}\mathrm{l}}^{-}} $ 对 $ {\rm {\mathrm{H}}_{2}{\mathrm{O}}_{2}} $ 分解有促进作用;
推论2:同浓度下, $ {\rm {\mathrm{F}\mathrm{e}}^{3+}} $ 对 $ {\rm {\mathrm{H}}_{2}{\mathrm{O}}_{2}} $ 分解的促进作用比 $ {\rm {\mathrm{C}\mathrm{u}}^{2+}} $ 强。
有小组同学认为推论2证据不足,原因是 。
③ 优化方案:小组同学设计如下方案进行实验(可选的试剂有蒸馏水、 $ {\rm 1\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}{\mathrm{F}\mathrm{e}\mathrm{C}\mathrm{l}}_{3}} $ 溶液、 $ {\rm 1\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}{\mathrm{C}\mathrm{u}\mathrm{C}\mathrm{l}}_{2}} $ 溶液、 $ {\rm 1\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}{\mathrm{C}\mathrm{u}\mathrm{S}\mathrm{O}}_{4}} $ 溶液、 $ {\rm 1\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}\mathrm{N}\mathrm{a}\mathrm{C}\mathrm{l}} $ 溶液和 $ {\rm 1\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}\mathrm{H}\mathrm{C}\mathrm{l}} $ 溶液)。
实验序号 | $ {\rm \mathrm{p}\mathrm{H}} $ | 试剂1 | 试剂2 | 试剂3 |
ⅰ | 5 | $ {\rm 10\mathrm{m}\mathrm{L}5\%{\mathrm{H}}_{2}{\mathrm{O}}_{2}} $ 溶液 | $ {\rm 1\mathrm{m}\mathrm{L}1\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}{\mathrm{F}\mathrm{e}\mathrm{C}\mathrm{l}}_{3}} $ 溶液 | |
ⅱ | 5 | $ {\rm 10\mathrm{m}\mathrm{L}5\%{\mathrm{H}}_{2}{\mathrm{O}}_{2}} $ 溶液 | $ {\rm 1\mathrm{m}\mathrm{L}1\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}{\mathrm{C}\mathrm{u}\mathrm{C}\mathrm{l}}_{2}} $ 溶液 | |
实验ⅰ中加入试剂3为 $ {\rm 1\mathrm{m}\mathrm{L}} $ ;实验ⅱ中加入试剂3为 。
④实验结论:依据实验ⅰ中 $ {\rm {\mathrm{H}}_{2}{\mathrm{O}}_{2}} $ 溶液分解速率大于实验 $ ⅱ $ ,可知推论2正确。
答案:(1)①13.5 ②BD
(2)①a>b>126 ②3 4
(3)FeCl3催化H2O2分解的反应速率越慢
(4)②由1 mol⋅L−1 CuCl2溶液和1 mol⋅L−1 CuSO4 溶液对应的实验数据可知,Cl-对H2O2分解有促进作用,而1 mL 1 mol⋅L−1 FeCl3 溶液中氯离子浓度大于1 mol⋅L−1 CuCl2溶液中氯离子浓度,则变量氯离子浓度不同,干扰实验探究
③蒸馏水 1 mL 1 mol⋅L− 1 NaCl溶液
解析:
① 配制时需称量 $ {\rm {\mathrm{F}\mathrm{e}\mathrm{C}\mathrm{l}}_{3}\cdot 6{\mathrm{H}}_{2}\mathrm{O}} $ 固体的质量 $ {\rm =50×{10}^{-3}\mathrm{L}×1\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}×270.5\mathrm{g}\cdot {\mathrm{m}\mathrm{o}\mathrm{l}}^{-1}\approx 13.5\mathrm{g}} $ 。
② 该过程中需要用到的玻璃仪器除烧杯、玻璃棒外,还有 $ {\rm 50\mathrm{m}\mathrm{L}} $ 容量瓶、胶头滴管,故选 $ {\rm \mathrm{B}\mathrm{D}} $ 。
(2) ① 该实验目的是探究 $ {\rm {\mathrm{H}}_{2}{\mathrm{O}}_{2}} $ 溶液浓度对反应速率的影响,实验1、2、3中 $ {\rm {\mathrm{H}}_{2}{\mathrm{O}}_{2}} $ 溶液浓度是单一变量,根据 $ {\rm {\mathrm{H}}_{2}{\mathrm{O}}_{2}} $ 溶液浓度越大,反应速率越快可知,相同时间内, $ {\rm {\mathrm{H}}_{2}{\mathrm{O}}_{2}} $ 溶液浓度越大,生成的气体越多,容器气压越大,故 $ 60\mathrm{s} $ 时容器气压 $ {\rm (\mathrm{k}\mathrm{P}\mathrm{a})} $ 关系: $ a > b > 126 $ 。
② 由表可知,实验3、4的单一变量为催化剂浓度,由 $ 60\mathrm{s} $ 时容器气压的数据得出结论:催化剂浓度越大,催化的能力越强。
(3) 由图乙可知,其他条件不变时, $ {\rm \mathrm{p}\mathrm{H}} $ 越小,溶液酸性越强,相同时间内容器压强变化越小,说明生成的气体越少, $ {\rm {\mathrm{F}\mathrm{e}\mathrm{C}\mathrm{l}}_{3}} $ 催化 $ {\rm {\mathrm{H}}_{2}{\mathrm{O}}_{2}} $ 分解的反应速率越慢。
③ 为探究 $ {\rm {\mathrm{F}\mathrm{e}}^{3+}} $ 和 $ {\rm {\mathrm{C}\mathrm{u}}^{2+}} $ 对 $ {\rm {\mathrm{H}}_{2}{\mathrm{O}}_{2}} $ 分解的促进作用,需控制变量,排除 $ {\rm {\mathrm{C}\mathrm{l}}^{-}} $ 的影响,保证实验ⅰ、ⅱ中 $ {\rm c({\mathrm{C}\mathrm{l}}^{-})} $ 相同,且实验ⅰ中 $ {\rm c({\mathrm{F}\mathrm{e}}^{3+})} $ 与实验ⅱ中 $ {\rm c({\mathrm{C}\mathrm{u}}^{2+})} $ 相同,则实验ⅰ中加入试剂3为 $ {\rm 1\mathrm{m}\mathrm{L}} $ 蒸馏水、实验ⅱ中加入试剂3为 $ {\rm 1\mathrm{m}\mathrm{L}1\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}\mathrm{N}\mathrm{a}\mathrm{C}\mathrm{l}} $ 溶液。
2.变量控制法是化学实验的一种常用方法。
如表是某学习小组研究稀硫酸和锌反应的实验数据。
序号 | 锌的质量/ $ \mathrm{g} $ | 锌的形式 | $ {\rm \dfrac{c({\mathrm{H}}_{2}{\mathrm{S}\mathrm{O}}_{4})}{\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}}} $ | $ {\rm \dfrac{V({\mathrm{H}}_{2}{\mathrm{S}\mathrm{O}}_{4})}{\mathrm{m}\mathrm{L}}} $ | 反应前溶液的温度/ $ ℃ $ | 其他试剂 |
1 | 0.65 | 粒状 | 0.5 | 50 | 20 | 无 |
2 | 0.65 | 粉末 | 0.5 | 50 | 20 | 无 |
3 | 0.65 | 粒状 | 0.5 | 50 | 20 | 2滴 $ {\rm {\mathrm{C}\mathrm{u}\mathrm{S}\mathrm{O}}_{4}} $ 溶液 |
4 | 0.65 | 粉末 | 0.8 | 50 | 20 | 无 |
5 | 0.65 | 粉末 | 0.8 | 50 | 35 | 2滴 $ {\rm {\mathrm{C}\mathrm{u}\mathrm{S}\mathrm{O}}_{4}} $ 溶液 |
回答下列问题:
(1) 判断锌和稀硫酸的反应速率大小,最简单的方法是通过测定 进行判断,在这5组实验中,反应速率最快的是 (填序号)。
(2) 实验1和2表明 对反应速率有影响,实验1和3对比发现实验3的反应速率明显较快,主要原因是 。
(3) 进行实验2时,小组同学根据实验过程绘制的氢气体积(标准状况下)与时间的关系如图所示。在 $ {\rm OA} $ 、 $ {\rm AB} $ 、 $ {\rm BC} $ 三段中反应速率最快的是 $ {\rm AB} $ 段,其原因是 。
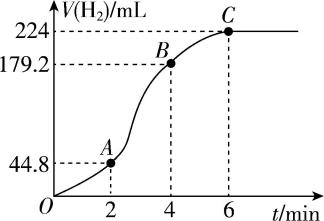
答案:(1) 锌完全消失所需的时间;5
(2) 固体反应物的表面积;实验3加入少量硫酸铜溶液,构成铜锌原电池
(3) 该反应放热,溶液温度升高,反应速率加快
解析:(1) 判断锌和稀硫酸的反应速率大小,最简单的方法是测定锌完全消失所需的时间;反应物接触面积越大、稀硫酸浓度越大、反应温度越高,反应速率越快,加入少量硫酸铜溶液,构成铜锌原电池,反应速率加快,在这5组实验中,反应速率最快的是5。
(2) 根据变量控制法,实验1和2的变量是固体反应物的表面积,故实验1和2表明固体反应物的表面积对反应速率有影响;实验1和3对比发现实验3的反应速率明显较快,主要原因是实验3加入少量硫酸铜溶液,构成铜锌原电池。
3.某实验小组为探究含硫化合物 $ {\rm ({\mathrm{N}\mathrm{H}}_{4})_{2}{\mathrm{S}}_{2}{\mathrm{O}}_{8}} $ 的性质,设计如下探究实验。
Ⅰ.实验操作:向小试管中加入 $ {\rm 2\mathrm{m}\mathrm{L}0.2\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}\mathrm{K}\mathrm{I}} $ 溶液,并滴入两滴淀粉溶液,无明显变化,再加入少量 $ {\rm 2\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}({\mathrm{N}\mathrm{H}}_{4})_{2}{\mathrm{S}}_{2}{\mathrm{O}}_{8}} $ 溶液,试管中溶液立即变蓝。取反应后溶液进行检验,发现存在 $ {\rm {\mathrm{S}\mathrm{O}}_{4}^{2-}} $ 。
(1) $ {\rm ({\mathrm{N}\mathrm{H}}_{4})_{2}{\mathrm{S}}_{2}{\mathrm{O}}_{8}} $ 与 $ {\rm \mathrm{K}\mathrm{I}} $ 反应的离子方程式为 。
(2) 检验反应后溶液中存在 $ {\rm {\mathrm{S}\mathrm{O}}_{4}^{2-}} $ 的具体操作及现象为 。
(3) 实验结论: $ {\rm ({\mathrm{N}\mathrm{H}}_{4})_{2}{\mathrm{S}}_{2}{\mathrm{O}}_{8}} $ 的氧化性 (填“强于”或“弱于”) $ {\rm {\mathrm{I}}_{2}} $ 。
Ⅱ.已知: $ {\rm {\mathrm{I}}_{2}} $ 可与 $ {\rm {\mathrm{S}}_{2}{\mathrm{O}}_{3}^{2-}} $ 发生反应 $ {\rm 2{\mathrm{S}}_{2}{\mathrm{O}}_{3}^{2-}+{\mathrm{I}}_{2}\xlongequal{}{\mathrm{S}}_{4}{\mathrm{O}}_{6}^{2-}+2{\mathrm{I}}^{-}} $ 。为了进一步探究 $ {\rm ({\mathrm{N}\mathrm{H}}_{4})_{2}{\mathrm{S}}_{2}{\mathrm{O}}_{8}} $ 与 $ {\rm \mathrm{K}\mathrm{I}} $ 的反应速率,该小组同学设计了如表实验:
实验编号 | ① | ② |
$ {\rm 0.2\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}\mathrm{K}\mathrm{I}} $ 溶液体积/ $ {\rm \mathrm{m}\mathrm{L}} $ | 4.0 | 4.0 |
$ {\rm 0.01\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}\mathrm{N}{\mathrm{a}}_{2}{\mathrm{S}}_{2}{\mathrm{O}}_{3}} $ 溶液体积/ $ {\rm \mathrm{m}\mathrm{L}} $ | 0 | 1.0 |
蒸馏水体积/ $ {\rm \mathrm{m}\mathrm{L}} $ | 4.0 | $ {\rm {V}_{1}} $ |
$ 0.4\% $ 的淀粉溶液/滴 | 2 | 2 |
$ {\rm 0.2\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}({\mathrm{N}\mathrm{H}}_{4})_{2}{\mathrm{S}}_{2}{\mathrm{O}}_{8}} $ 溶液体积/ $ {\rm \mathrm{m}\mathrm{L}} $ | 2.0 | $ {\rm {V}_{2}} $ |
实验①中溶液立即变色,实验②中溶液在 $ 30\mathrm{s} $ 时变色。
(4) 上述实验②中的 $ {\rm {V}_{1}=} $ , $ {\rm {V}_{2}=} $ 。
加入 $ {\rm {\mathrm{N}\mathrm{a}}_{2}{\mathrm{S}}_{2}{\mathrm{O}}_{3}} $ 溶液后溶液变蓝的时间明显增长,小组同学对此提出两种猜想。
猜想 $ {\rm 1:({\mathrm{N}\mathrm{H}}_{4})_{2}{\mathrm{S}}_{2}{\mathrm{O}}_{8}} $ 与 $ {\rm \mathrm{K}\mathrm{I}} $ 反应的速率远低于 $ {\rm {\mathrm{I}}_{2}} $ 与 $ {\rm {\mathrm{N}\mathrm{a}}_{2}{\mathrm{S}}_{2}{\mathrm{O}}_{3}} $ 反应的速率;
猜想 $ {\rm 2:({\mathrm{N}\mathrm{H}}_{4})_{2}{\mathrm{S}}_{2}{\mathrm{O}}_{8}} $ 先与 $ {\rm {\mathrm{N}\mathrm{a}}_{2}{\mathrm{S}}_{2}{\mathrm{O}}_{3}} $ 反应, $ {\rm {\mathrm{N}\mathrm{a}}_{2}{\mathrm{S}}_{2}{\mathrm{O}}_{3}} $ 消耗完后才与 $ {\rm {\mathrm{I}}^{-}} $ 反应。
为验证上述猜想,该小组同学补充了如表实验:
实验编号 | ③ | ④ |
$ {\rm 0.2\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}\mathrm{K}\mathrm{I}} $ 溶液体积/ $ {\rm \mathrm{m}\mathrm{L}} $ | 2 | 0 |
$ {\rm 0.001\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}} $ 碘水体积/ $ {\rm \mathrm{m}\mathrm{L}} $ | 0 | 5 |
$ {\rm 0.01\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}{\mathrm{N}\mathrm{a}}_{2}{\mathrm{S}}_{2}{\mathrm{O}}_{3}} $ 液体积/ $ {\rm \mathrm{m}\mathrm{L}} $ | 20 | 20 |
$ {\rm {\mathrm{C}\mathrm{C}\mathrm{l}}_{4}} $ 体积/ $ {\rm \mathrm{m}\mathrm{L}} $ | 10 | 0 |
$ 0.4\% $ 的淀粉溶液/滴 | 0 | 2 |
$ {\rm 0.2\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}({\mathrm{N}\mathrm{H}}_{4})_{2}{{\mathrm{S}}_{2}\mathrm{O}}_{8};} $ 溶液体积/ $ {\rm \mathrm{m}\mathrm{L}} $ | 0.2 | 20 |
实验③下层溶液显浅紫色;实验④溶液先变蓝,后迅速褪色,一段时间后又变蓝。
(5) 验证猜想1的实验设计为 (填“实验③”或“实验④”,下同),验证猜想2的实验设计为 。
(6) 实验③中下层溶液显浅紫色的原因为 。
(7) 由上述实验可知 (填“猜想1”或“猜想2”)成立。
答案:(1) $ {\rm {\mathrm{S}}_{2}{\mathrm{O}}_{8}^{2-}+2{\mathrm{I}}^{-}\xlongequal{}2{\mathrm{S}\mathrm{O}}_{4}^{2-}+{\mathrm{I}}_{2}} $
(2) 取少量反应后溶液于试管中,滴加过量盐酸,无沉淀生成,再滴加 $ {\rm {\mathrm{B}\mathrm{a}\mathrm{C}\mathrm{l}}_{2}} $ 溶液,产生白色沉淀
(3) 强于
(4) 3.0;2.0
(5) 实验④;实验③
(6) 反应过程中有 $ {\rm {\mathrm{I}}_{2}} $ 生成, $ {\rm {\mathrm{I}}_{2}} $ 溶于 $ {\rm {\mathrm{C}\mathrm{C}\mathrm{l}}_{4}} $
(7) 猜想1
解析:(1) 碘单质能使淀粉溶液变蓝色。试管中溶液立即变蓝,即生成了 $ {\rm {\mathrm{I}}_{2}} $ ,取反应后溶液检验,溶液中存在 $ {\rm {\mathrm{S}\mathrm{O}}_{4}^{2-}} $ ,则 $ {\rm ({\mathrm{N}\mathrm{H}}_{4})_{2}{\mathrm{S}}_{2}{\mathrm{O}}_{8}} $ 与 $ {\rm \mathrm{K}\mathrm{I}} $ 反应生成碘单质和硫酸根离子,故反应的离子方程式为 $ {\rm {\mathrm{S}}_{2}{\mathrm{O}}_{8}^{2-}+2{\mathrm{I}}^{-}\xlongequal{}2{\mathrm{S}\mathrm{O}}_{4}^{2-}+{\mathrm{I}}_{2}} $ 。
(3) 氧化剂的氧化性强于氧化产物, $ {\rm ({\mathrm{N}\mathrm{H}}_{4})_{2}{\mathrm{S}}_{2}{\mathrm{O}}_{8}} $ 是氧化剂, $ {\rm {\mathrm{I}}_{2}} $ 是氧化产物,故 $ {\rm ({\mathrm{N}\mathrm{H}}_{4})_{2}{\mathrm{S}}_{2}{\mathrm{O}}_{8}} $ 的氧化性强于 $ {\rm {\mathrm{I}}_{2}} $ 。
(4) 加入蒸馏水的目的是控制单一变量,使混合溶液总体积相等,保证除了 $ {\rm {\mathrm{N}\mathrm{a}}_{2}{\mathrm{S}}_{2}{\mathrm{O}}_{3}} $ 外,其他物质浓度均相等,则有 $ {\rm {V}_{1}=3.0} $ , $ {\rm {V}_{2}=2.0} $ 。
(5) 实验③证明反应过程中有 $ {\rm {\mathrm{I}}_{2}} $ 生成,验证猜想2,实验④体现了反应速率,验证猜想1。
(6) 碘极易溶于四氯化碳,下层溶液显浅紫色的原因为实验③过程中有 $ {\rm {\mathrm{I}}_{2}} $ 生成, $ {\rm {\mathrm{I}}_{2}} $ 溶于 $ {\rm {\mathrm{C}\mathrm{C}\mathrm{l}}_{4}} $ 显浅紫色。
(7) 实验③证明反应过程中有 $ {\rm {\mathrm{I}}_{2}} $ 生成,验证猜想2;实验④体现了反应速率,验证猜想1,实验现象说明该过程中淀粉溶液遇碘变蓝,然后碘单质迅速与 $ {\rm {\mathrm{N}\mathrm{a}}_{2}{\mathrm{S}}_{2}{\mathrm{O}}_{3}} $ 反应生成 $ {\rm {\mathrm{I}}^{-}} $ ,导致溶液褪色,最后 $ {\rm {\mathrm{I}}^{-}} $ 与 $ {\rm {\mathrm{S}}_{2}{\mathrm{O}}_{8}^{2-}} $ 反应生成碘单质,溶液又变蓝,故猜想1成立。




