1. $ {\rm {\mathrm{C}\mathrm{l}}_{2}} $ 和 $ {\rm {\mathrm{S}\mathrm{O}}_{2}} $ 化合可制得硫酰氯 $ {\rm ({\mathrm{S}\mathrm{O}}_{2}{\mathrm{C}\mathrm{l}}_{2})} $ ,某同学设计合成 $ {\rm {\mathrm{S}\mathrm{O}}_{2}{\mathrm{C}\mathrm{l}}_{2}} $ 的装置如图所示(省略部分夹持仪器) $ : $
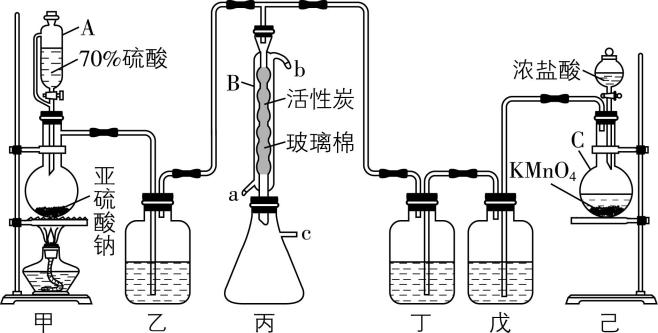
已知: $ {\rm {\mathrm{S}\mathrm{O}}_{2}{\mathrm{C}\mathrm{l}}_{2}} $ 熔点为 $ -54.1℃ $ ,沸点为 $ 69.1℃ $ ,遇水迅速反应生成两种强酸,且高温条件下不稳定。
回答下列问题:
(1) 仪器C的名称为 ,仪器A相比于普通分液漏斗的优势在于 。
(2) 装置乙中试剂的名称是 ,能替代装置己中 $ {\rm {\mathrm{K}\mathrm{M}\mathrm{n}\mathrm{O}}_{4}} $ 的是 (填序号)。
$ \mathrm{a} $ .氯酸钾 $ \mathrm{b} $ .二氧化锰 $ \mathrm{c} $ .浓硝酸 $ \mathrm{d} $ .漂白粉
(3) 有同学认为上述装置还有缺陷,改进方法是在装置丙的 $ \mathrm{c} $ 处连接 (填序号)。
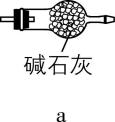
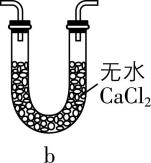
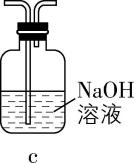
(4) 若缺少装置乙和丁,会降低硫酰氯的产率,原因是 (用化学方程式表示)。
(5) 实验过程中,由仪器B的 $ \mathrm{a} $ 端通入冷却水,作用是 。
答案:(1) 圆底烧瓶;平衡压强,使液体顺利流下
(2) 浓硫酸; $ \mathrm{a}\mathrm{d} $
(3) $ \mathrm{a}( $ 或 $ \mathrm{b}\mathrm{c} $ 、 $ \mathrm{d}\mathrm{c}) $
(4) $ {\rm {\mathrm{S}\mathrm{O}}_{2}{\mathrm{C}\mathrm{l}}_{2}+2{\mathrm{H}}_{2}\mathrm{O}\xlongequal{}{\mathrm{H}}_{2}{\mathrm{S}\mathrm{O}}_{4}+2\mathrm{H}\mathrm{C}\mathrm{l}} $
(5) 冷凝 $ {\rm {\mathrm{S}\mathrm{O}}_{2}{\mathrm{C}\mathrm{l}}_{2}} $ ,便于收集,同时防止 $ {\rm {\mathrm{S}\mathrm{O}}_{2}{\mathrm{C}\mathrm{l}}_{2}} $ 高温分解
解析:(1) 仪器 $ {\rm \mathrm{C}} $ 的名称为圆底烧瓶;仪器 $ {\rm \mathrm{A}} $ 中侧支管可以保持漏斗中的压强和烧瓶中的压强相等,故其相比于普通分液漏斗的优势在于平衡压强,使液体顺利流下。
(2) 装置甲用来制备二氧化硫,装置乙用来干燥二氧化硫,故其中的试剂为浓硫酸;装置己中 $ {\rm {\mathrm{K}\mathrm{M}\mathrm{n}\mathrm{O}}_{4}} $ 具有强氧化性,可以和浓盐酸反应生成氯气,氯酸钾和漂白粉中的次氯酸根离子具有强氧化性,常温下可以和浓盐酸反应生成氯气,而二氧化锰和浓盐酸反应制备氯气需要加热,故能替代装置己中 $ {\rm {\mathrm{K}\mathrm{M}\mathrm{n}\mathrm{O}}_{4}} $ 的是 $ \mathrm{a}\mathrm{d} $ 。
(3) 根据已知信息可知, $ {\rm {\mathrm{S}\mathrm{O}}_{2}{\mathrm{C}\mathrm{l}}_{2}} $ 遇水迅速反应生成两种强酸,且反应过程中使用了有毒的氯气和二氧化硫,则反应过程中要防止 $ {\rm {\mathrm{C}\mathrm{l}}_{2}} $ 和 $ {\rm {\mathrm{S}\mathrm{O}}_{2}} $ 排入空气中,且要防止空气中的水蒸气进入装置丙中,则改进方法是在装置丙的 $ \mathrm{c} $ 处连接 $ \mathrm{a} $ 或 $ \mathrm{b}\mathrm{c} $ 、 $ \mathrm{d}\mathrm{c} $ 。
(4) 由思路导引可知,装置乙和丁都起到干燥的作用,根据已知信息可知, $ {\rm {\mathrm{S}\mathrm{O}}_{2}{\mathrm{C}\mathrm{l}}_{2}} $ 遇水迅速反应生成两种强酸,则若缺少装置乙和丁,会降低硫酰氯的产率,原因是 $ {\rm {\mathrm{S}\mathrm{O}}_{2}{\mathrm{C}\mathrm{l}}_{2}+2{\mathrm{H}}_{2}\mathrm{O}\xlongequal{}{\mathrm{H}}_{2}{\mathrm{S}\mathrm{O}}_{4}+2\mathrm{H}\mathrm{C}\mathrm{l}} $ 。
(5) 根据已知信息可知, $ {\rm {\mathrm{S}\mathrm{O}}_{2}{\mathrm{C}\mathrm{l}}_{2}} $ 高温条件下不稳定,故由仪器 $ {\rm \mathrm{B}} $ 的 $ \mathrm{a} $ 端通入冷却水,作用是冷凝 $ {\rm {\mathrm{S}\mathrm{O}}_{2}{\mathrm{C}\mathrm{l}}_{2}} $ ,便于收集,同时防止 $ {\rm {\mathrm{S}\mathrm{O}}_{2}{\mathrm{C}\mathrm{l}}_{2}} $ 高温分解。
2.亚硝酸钙 $ {\rm [\mathrm{C}\mathrm{a} ({\mathrm{N}\mathrm{O}}_{2})_{2} ]} $ 是水泥混凝土外加剂的主要原料,某学习小组设计实验制备 $ {\rm \mathrm{C}\mathrm{a}({\mathrm{N}\mathrm{O}}_{2})_{2}} $ ,实验装置如图所示(夹持装置略去):
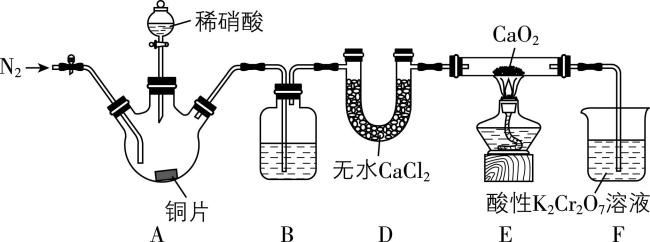
已知: $ {\rm 2\mathrm{N}\mathrm{O}+{\mathrm{C}\mathrm{a}\mathrm{O}}_{2}\xlongequal{△}\mathrm{C}\mathrm{a}({\mathrm{N}\mathrm{O}}_{2})_{2}} $ ; $ {\rm 2{\mathrm{N}\mathrm{O}}_{2}+{\mathrm{C}\mathrm{a}\mathrm{O}}_{2}\xlongequal{△}\mathrm{C}\mathrm{a}({\mathrm{N}\mathrm{O}}_{3})_{2}} $ 。
请回答下列问题:
(1) 请写出装置A中发生反应的化学方程式: 。
(2) 装置D中盛装无水氯化钙的仪器名称是 。
(3) 装置B中盛放的试剂可能是 (填序号)。
$ {\rm \mathrm{a}.{\mathrm{H}}_{2}\mathrm{O}} $ $ {\rm \mathrm{b}.\mathrm{N}\mathrm{a}\mathrm{O}\mathrm{H}} $ 溶液 $ \mathrm{c} $ .酸性 $ {\rm {\mathrm{K}\mathrm{M}\mathrm{n}\mathrm{O}}_{4}} $ 溶液
(4) 加入稀硝酸之前,应向装置中通入一段时间的 $ {\rm {\mathrm{N}}_{2}} $ ,原因是 。
(5) 利用上述装置制备亚硝酸钙,会导致产率降低,改进的方法是 。
答案:(1) $ {\rm 3\mathrm{C}\mathrm{u}+8{\mathrm{H}\mathrm{N}\mathrm{O}}_{3}} $ (稀) $ {\rm \xlongequal{}3\mathrm{C}\mathrm{u}({\mathrm{N}\mathrm{O}}_{3})_{2}+2\mathrm{N}\mathrm{O}↑+4{\mathrm{H}}_{2}\mathrm{O}} $
(2) $ {\rm \mathrm{U}} $ 形管
(3) $ \mathrm{a}\mathrm{b} $
(4) 排除装置中的空气,防止其将生成的 $ {\rm \mathrm{N}\mathrm{O}} $ 氧化为 $ {\rm {\mathrm{N}\mathrm{O}}_{2}} $
(5) 在 $ {\rm \mathrm{E}} $ 、 $ {\rm \mathrm{F}} $ 之间加装盛放浓硫酸的洗气瓶(或在 $ {\rm \mathrm{E}} $ 、 $ {\rm \mathrm{F}} $ 之间加装盛装无水 $ {\rm {\mathrm{C}\mathrm{a}\mathrm{C}\mathrm{l}}_{2}} $ 的干燥管)
解析:(1) 在装置 $ {\rm \mathrm{A}} $ 中 $ {\rm \mathrm{C}\mathrm{u}} $ 与稀硝酸反应产生 $ {\rm \mathrm{C}\mathrm{u}({\mathrm{N}\mathrm{O}}_{3})_{2}} $ 、 $ {\rm \mathrm{N}\mathrm{O}} $ 和 $ {\rm {\mathrm{H}}_{2}\mathrm{O}} $ ,该反应的化学方程式为 $ {\rm 3\mathrm{C}\mathrm{u}+8{\mathrm{H}\mathrm{N}\mathrm{O}}_{3}} $ (稀) $ {\rm \xlongequal{}3\mathrm{C}\mathrm{u}({\mathrm{N}\mathrm{O}}_{3})_{2}+2\mathrm{N}\mathrm{O}↑+4{\mathrm{H}}_{2}\mathrm{O}} $ 。
(2) 由图可知,装置 $ {\rm \mathrm{D}} $ 中盛装无水氯化钙的仪器名称是 $ {\rm \mathrm{U}} $ 形管。
(3) $ {\rm \mathrm{C}\mathrm{u}} $ 与稀 $ {\rm {\mathrm{H}\mathrm{N}\mathrm{O}}_{3}} $ 反应放出热量,可能促进硝酸分解产生 $ {\rm {\mathrm{N}\mathrm{O}}_{2}} $ 和 $ {\rm {\mathrm{O}}_{2}} $ , $ {\rm {\mathrm{O}}_{2}} $ 又可能氧化 $ {\rm \mathrm{N}\mathrm{O}} $ 产生少量 $ {\rm {\mathrm{N}\mathrm{O}}_{2}} $ ,从而干扰实验。为除去 $ {\rm {\mathrm{N}\mathrm{O}}_{2}} $ 可以在装置 $ {\rm \mathrm{B}} $ 中盛放水, $ {\rm {\mathrm{N}\mathrm{O}}_{2}} $ 和水发生反应: $ {\rm 3{\mathrm{N}\mathrm{O}}_{2}+{\mathrm{H}}_{2}\mathrm{O}\xlongequal{}2{\mathrm{H}\mathrm{N}\mathrm{O}}_{3}+\mathrm{N}\mathrm{O}} $ ,同时水也能吸收挥发的硝酸蒸气;另外氢氧化钠也可以和二氧化氮反应生成硝酸钠、亚硝酸钠和水,故装置 $ {\rm \mathrm{B}} $ 中所加试剂可能是水或 $ {\rm \mathrm{N}\mathrm{a}\mathrm{O}\mathrm{H}} $ 溶液,故选 $ \mathrm{a}\mathrm{b} $ 。
(4) 一氧化氮可以和氧气反应,则通入 $ {\rm {\mathrm{N}}_{2}} $ 的作用是排尽空气,防止生成的 $ {\rm \mathrm{N}\mathrm{O}} $ 被 $ {\rm {\mathrm{O}}_{2}} $ 氧化。
(5) $ {\rm \mathrm{F}} $ 中的水蒸气进入 $ {\rm \mathrm{E}} $ 中会与过氧化钙反应,从而导致亚硝酸钙产率降低,故应在 $ {\rm \mathrm{E}} $ 、 $ {\rm \mathrm{F}} $ 之间加装盛放浓硫酸的洗气瓶或盛装无水 $ {\rm {\mathrm{C}\mathrm{a}\mathrm{C}\mathrm{l}}_{2}} $ 的干燥管。
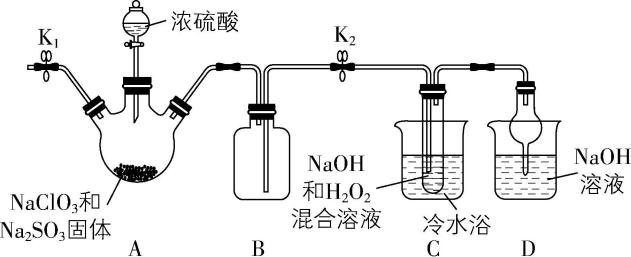
3. $ {\rm {\mathrm{N}\mathrm{a}\mathrm{C}\mathrm{l}\mathrm{O}}_{2}} $ 是重要的漂白剂和消毒剂,主要用于砂糖、油脂的漂白杀菌。实验室制备 $ {\rm {\mathrm{N}\mathrm{a}\mathrm{C}\mathrm{l}\mathrm{O}}_{2}} $ 的装置如图甲所示。
甲 乙
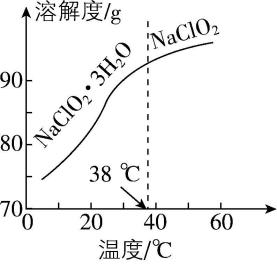
已知: $ {\rm ①{\mathrm{N}\mathrm{a}\mathrm{C}\mathrm{l}\mathrm{O}}_{2}} $ 的溶解度曲线如图乙所示;若溶液温度高于 $ 60℃ $ , $ {\rm {\mathrm{N}\mathrm{a}\mathrm{C}\mathrm{l}\mathrm{O}}_{2}} $ 发生分解;
②装置A中发生的主要反应: $ {\rm 2{\mathrm{N}\mathrm{a}\mathrm{C}\mathrm{l}\mathrm{O}}_{3}+{\mathrm{N}\mathrm{a}}_{2}{\mathrm{S}\mathrm{O}}_{3}+{\mathrm{H}}_{2}{\mathrm{S}\mathrm{O}}_{4}(浓)\xlongequal{}2{\mathrm{C}\mathrm{l}\mathrm{O}}_{2}↑+2{\mathrm{N}\mathrm{a}}_{2}{\mathrm{S}\mathrm{O}}_{4}+{\mathrm{H}}_{2}\mathrm{O}} $ 。
请回答:
(1) 装置B的作用是 。
(2) 下列实验操作一定能提高 $ {\rm {\mathrm{C}\mathrm{l}\mathrm{O}}_{2}} $ 吸收效率的有 (填序号)。
A. 装置C采用热水浴
B. 加快滴加浓硫酸的速率
C. 适当提高 $ {\rm {\mathrm{H}}_{2}{\mathrm{O}}_{2}} $ 的浓度
D. 通过多孔球泡向装置C的混合溶液中通 $ {\rm {\mathrm{C}\mathrm{l}\mathrm{O}}_{2}} $
(3) 装置C试管中获得的产品往往混有 $ {\rm {\mathrm{N}\mathrm{a}}_{2}{\mathrm{S}\mathrm{O}}_{4}} $ 杂质,原因是 。
(4) 反应结束后,取装置C试管中的溶液,在略低于 $ 60℃ $ 减压蒸发至有大量晶体析出,趁热过滤,用 $ ℃ $ (填温度范围)的蒸馏水洗涤晶体,至取最后一次洗涤液检验洗涤干净后,低温干燥,得到 $ {\rm {\mathrm{N}\mathrm{a}\mathrm{C}\mathrm{l}\mathrm{O}}_{2}} $ 晶体。
(5) 产品中 $ {\rm {\mathrm{N}\mathrm{a}\mathrm{C}\mathrm{l}\mathrm{O}}_{2}} $ 质量分数的测定:称取 $ 5.000\mathrm{g} $ 产品配成 $ {\rm 250\mathrm{m}\mathrm{L}} $ 溶液;取 $ {\rm 25.00\mathrm{m}\mathrm{L}} $ 所配溶液,加入足量 $ {\rm \mathrm{K}\mathrm{I}} $ 溶液和稀硫酸,发生反应: $ {\rm 4{\mathrm{I}}^{-}+4{\mathrm{H}}^{+}+{\mathrm{C}\mathrm{l}\mathrm{O}}_{2}^{-}\xlongequal{}2{\mathrm{I}}_{2}+{\mathrm{C}\mathrm{l}}^{-}+2{\mathrm{H}}_{2}\mathrm{O}} $ ;向充分反应后的混合物中逐滴加入 $ {\rm 0.8400\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}{\mathrm{N}\mathrm{a}}_{2}{\mathrm{S}}_{2}{\mathrm{O}}_{3}} $ 溶液至恰好完全反应 $ {\rm (2{\mathrm{N}\mathrm{a}}_{2}{\mathrm{S}}_{2}{\mathrm{O}}_{3}+{\mathrm{I}}_{2}\xlongequal{}{\mathrm{N}\mathrm{a}}_{2}{\mathrm{S}}_{4}{\mathrm{O}}_{6}+2\mathrm{N}\mathrm{a}\mathrm{I})} $ ,消耗 $ {\rm {\mathrm{N}\mathrm{a}}_{2}{\mathrm{S}}_{2}{\mathrm{O}}_{3}} $ 溶液 $ {\rm 20.00\mathrm{m}\mathrm{L}} $ 。
① 若加入 $ {\rm \mathrm{K}\mathrm{I}} $ 溶液后在空气中放置时间过长,会导致所测得的 $ {\rm {\mathrm{N}\mathrm{a}\mathrm{C}\mathrm{l}\mathrm{O}}_{2}} $ 的质量分数 (填“偏高”“偏低”或“无影响”)。
② 若产品中杂质不与 $ {\rm \mathrm{K}\mathrm{I}} $ 、 $ {\rm {\mathrm{N}\mathrm{a}\mathrm{C}\mathrm{l}\mathrm{O}}_{2}} $ 发生反应,则产品中 $ {\rm {\mathrm{N}\mathrm{a}\mathrm{C}\mathrm{l}\mathrm{O}}_{2}} $ 的质量分数为 。
答案:(1) 防止试管C中液体进入A中(或作安全瓶,防倒吸)
(2) CD
(3) $ {\rm {\mathrm{N}\mathrm{a}}_{2}{\mathrm{S}\mathrm{O}}_{3}} $ 与浓硫酸反应生成的 $ {\rm {\mathrm{S}\mathrm{O}}_{2}} $ 进入C中被 $ {\rm {\mathrm{H}}_{2}{\mathrm{O}}_{2}} $ 氧化
(4) $ 38~60 $
(5) ① 偏高
② $ 76.02\% $
解析:(1) 装置 $ {\rm \mathrm{B}} $ 的作用是防止试管 $ {\rm \mathrm{C}} $ 中液体进入 $ {\rm \mathrm{A}} $ 中(或作安全瓶,防倒吸)。
(2) 若装置 $ {\rm \mathrm{C}} $ 采用热水浴,温度过高过氧化氢、 $ {\rm {\mathrm{N}\mathrm{a}\mathrm{C}\mathrm{l}\mathrm{O}}_{2}} $ 均会分解,会降低 $ {\rm {\mathrm{C}\mathrm{l}\mathrm{O}}_{2}} $ 的吸收效率, $ {\rm \mathrm{A}} $ 不符合题意;加快滴加浓硫酸的速率,产生 $ {\rm {\mathrm{C}\mathrm{l}\mathrm{O}}_{2}} $ 的速率会变快, $ {\rm {\mathrm{C}\mathrm{l}\mathrm{O}}_{2}} $ 不能充分反应,会降低 $ {\rm {\mathrm{C}\mathrm{l}\mathrm{O}}_{2}} $ 吸收效率, $ {\rm \mathrm{B}} $ 不符合题意;适当提高 $ {\rm {\mathrm{H}}_{2}{\mathrm{O}}_{2}} $ 的浓度,使反应更充分,可以加快反应速率,提高 $ {\rm {\mathrm{C}\mathrm{l}\mathrm{O}}_{2}} $ 的吸收效率, $ {\rm \mathrm{C}} $ 符合题意;通过多孔球泡向装置 $ {\rm \mathrm{C}} $ 的混合溶液中通 $ {\rm {\mathrm{C}\mathrm{l}\mathrm{O}}_{2}} $ ,增大气体和液体的接触面积,可以加快反应速率,提高 $ {\rm {\mathrm{C}\mathrm{l}\mathrm{O}}_{2}} $ 的吸收效率, $ {\rm \mathrm{D}} $ 符合题意。
(3) 装置 $ {\rm \mathrm{C}} $ 试管中获得的产品往往混有 $ {\rm {\mathrm{N}\mathrm{a}}_{2}{\mathrm{S}\mathrm{O}}_{4}} $ 杂质,是因为 $ {\rm \mathrm{A}} $ 中 $ {\rm {\mathrm{N}\mathrm{a}}_{2}{\mathrm{S}\mathrm{O}}_{3}} $ 与浓硫酸反应生成的 $ {\rm {\mathrm{S}\mathrm{O}}_{2}} $ 进入 $ {\rm \mathrm{C}} $ 中被 $ {\rm {\mathrm{H}}_{2}{\mathrm{O}}_{2}} $ 氧化生成 $ {\rm {\mathrm{N}\mathrm{a}}_{2}{\mathrm{S}\mathrm{O}}_{4}} $ 。
(4) 反应结束后,取装置 $ {\rm \mathrm{C}} $ 试管中的溶液,在略低于 $ 60℃ $ 减压蒸发至有大量晶体析出,趁热过滤,由图乙可知,在高于 $ 38℃ $ 时析出的晶体是 $ {\rm {\mathrm{N}\mathrm{a}\mathrm{C}\mathrm{l}\mathrm{O}}_{2}} $ 且温度高于 $ {\rm 60℃{\mathrm{N}\mathrm{a}\mathrm{C}\mathrm{l}\mathrm{O}}_{2}} $ 会发生分解,所以用 $ 38~60℃ $ 的蒸馏水洗涤晶体。
(5) ① 若加入 $ {\rm \mathrm{K}\mathrm{I}} $ 溶液后在空气中放置时间过长,部分碘离子会被空气中 $ {\rm {\mathrm{O}}_{2}} $ 氧化为碘单质,导致消耗的 $ {\rm {\mathrm{N}\mathrm{a}}_{2}{\mathrm{S}}_{2}{\mathrm{O}}_{3}} $ 增多,使所测得的 $ {\rm {\mathrm{N}\mathrm{a}\mathrm{C}\mathrm{l}\mathrm{O}}_{2}} $ 的质量分数偏高。
② 测定过程消耗 $ {\rm {\mathrm{N}\mathrm{a}}_{2}{\mathrm{S}}_{2}{\mathrm{O}}_{3}} $ 溶液 $ {\rm 20.00\mathrm{m}\mathrm{L}} $ ,消耗的 $ {\rm n({\mathrm{N}\mathrm{a}}_{2}{\mathrm{S}}_{2}{\mathrm{O}}_{3})=0.8400\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}×20.00×{10}^{-3}\mathrm{L}=0.0168\mathrm{m}\mathrm{o}\mathrm{l}} $ ,根据反应 $ {\rm 4{\mathrm{I}}^{-}+4{\mathrm{H}}^{+}+{\mathrm{C}\mathrm{l}\mathrm{O}}_{2}^{-}\xlongequal{}2{\mathrm{I}}_{2}+{\mathrm{C}\mathrm{l}}^{-}+2{\mathrm{H}}_{2}\mathrm{O}} $ 、 $ {\rm 2{\mathrm{N}\mathrm{a}}_{2}{\mathrm{S}}_{2}{\mathrm{O}}_{3}+{\mathrm{I}}_{2}\xlongequal{}{\mathrm{N}\mathrm{a}}_{2}{\mathrm{S}}_{4}{\mathrm{O}}_{6}+2\mathrm{N}\mathrm{a}\mathrm{I}} $ 可得关系式: $ {\rm {\mathrm{N}\mathrm{a}\mathrm{C}\mathrm{l}\mathrm{O}}_{2}\sim 2{\mathrm{I}}_{2}\sim 4{\mathrm{N}\mathrm{a}}_{2}{\mathrm{S}}_{2}{\mathrm{O}}_{3}} $ ,则 $ {\rm n({\mathrm{N}\mathrm{a}\mathrm{C}\mathrm{l}\mathrm{O}}_{2})=\dfrac{1}{4}×n({\mathrm{N}\mathrm{a}}_{2}{\mathrm{S}}_{2}{\mathrm{O}}_{3})=0.0042\mathrm{m}\mathrm{o}\mathrm{l}} $ ,则 $ 5.000\mathrm{g} $ 产品中 $ {\rm m({\mathrm{N}\mathrm{a}\mathrm{C}\mathrm{l}\mathrm{O}}_{2})=0.0042\mathrm{m}\mathrm{o}\mathrm{l}×\dfrac{250\mathrm{m}\mathrm{L}}{25.00\mathrm{m}\mathrm{L}}×90.5\mathrm{g}\cdot {\mathrm{m}\mathrm{o}\mathrm{l}}^{-1}=3.801\mathrm{g}} $ ,则产品中 $ {\rm {\mathrm{N}\mathrm{a}\mathrm{C}\mathrm{l}\mathrm{O}}_{2}} $ 的质量分数为 $ \dfrac{3.801\mathrm{g}}{5.000\mathrm{g}}×100\%=76.02\% $ 。
4.科学探究与创新意识是化学学科核心素养之一。回答下列问题:
Ⅰ.某研究性学习小组欲探究原电池的形成条件,按如图甲所示装置进行实验并得到表中的实验结果。
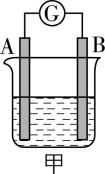
实验编号 | A | B | 烧杯中的液体 | 灵敏电流计指针是否偏转 |
① | $ {\rm \mathrm{F}\mathrm{e}} $ | $ {\rm \mathrm{C}\mathrm{u}} $ | 稀硫酸 | 是 |
② | $ {\rm \mathrm{F}\mathrm{e}} $ | $ {\rm \mathrm{F}\mathrm{e}} $ | 稀硫酸 | 否 |
③ | $ {\rm \mathrm{F}\mathrm{e}} $ | $ {\rm \mathrm{C}\mathrm{u}} $ | 苯 | 否 |
④ | $ {\rm \mathrm{F}\mathrm{e}} $ | $ {\rm \mathrm{C}\mathrm{u}} $ | 浓硝酸 | 是 |
⑤ | C | $ {\rm \mathrm{F}\mathrm{e}} $ | 氯化钠溶液 | 是 |
(1) 实验①的导线中电子流向为 (填“ $ {\rm \mathrm{A}\to \mathrm{B}} $ ”或“ $ {\rm \mathrm{B}\to \mathrm{A}} $ ”)。
(2) 实验④的导线中电流由A极流向B极,表明负极是 (填元素名称)电极,正极反应式为 。
(3) 分析表中有关信息,下列说法错误的是 (填序号)。
$ \mathrm{a} $ .烧杯中的液体必须是电解质溶液
$ \mathrm{b} $ .相对活泼的金属一定作负极
$ \mathrm{c} $ .钢铁在潮湿的空气中不会被腐蚀
$ \mathrm{d} $ .利用原电池电极反应判断金属活动性顺序时应注意选择合适的介质
Ⅱ.某化学兴趣小组研究钠与不同浓度盐酸的反应。
【实验操作】
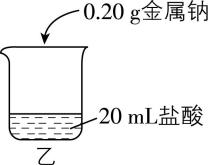
取5块质量均为 $ 0.20\mathrm{g} $ 且形状相似的金属钠,分别放入 $ {\rm 20\mathrm{m}\mathrm{L}} $ 不同浓度的盐酸中,如图乙所示。
【实验现象与数据】
实验编号 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
$ {\rm \dfrac{c(\mathrm{H}\mathrm{C}\mathrm{l})}{\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}}} $ | 0.5 | 1.0 | 1.5 | 3.0 | 6.0 |
主要现象 | 钠浮在液面上,四处游动 |
钠燃烧,溶液澄清 | 钠短时燃烧,溶液澄清 | 钠的表面有火花,溶液澄清 | 钠的表面有少量火花,溶液澄清 | 钠的周围出现白色浑浊,一段时间后溶液变澄清 |
钠完全消失所用的时间/ $ \mathrm{s} $ | 11 | 21 | 37 | 65 | 114 |
经检验,实验⑩中出现的白色浑浊成分为 $ {\rm \mathrm{N}\mathrm{a}\mathrm{C}\mathrm{l}} $ 。
【问题与讨论】
(4) 写出钠与盐酸反应的离子方程式: 。
(5) 实验⑥中能说明钠与盐酸反应放热的实验现象是 。
(6) 在上述实验中,盐酸浓度越大,钠完全消失所用的时间 (填“越长”或“越短”)。
(7) 实验⑩中钠完全消失所用的时间最长,反应速率最慢,原因可能是 。
答案:(1) $ {\rm \mathrm{A}\to \mathrm{B}} $
(2) 铜; $ {\rm {\mathrm{N}\mathrm{O}}_{3}^{-}+{\mathrm{e}}^{-}+2{\mathrm{H}}^{+}\xlongequal{}{\mathrm{N}\mathrm{O}}_{2}↑+{\mathrm{H}}_{2}\mathrm{O}} $
(3) $ \mathrm{b}\mathrm{c} $
(4) $ {\rm 2\mathrm{N}\mathrm{a}+2{\mathrm{H}}^{+}\xlongequal{}2{\mathrm{N}\mathrm{a}}^{+}+{\mathrm{H}}_{2}↑} $
(5) 钠燃烧
(6) 越长
(7) 生成的氯化钠减小了钠与盐酸的接触面积
解析:4.控制变量的实验探究中要注意变量的唯一性,实验通过控制变量,研究某一因素对实验结果的影响;原电池中电子由负极通过外电路向正极移动,电流由正极流向负极。
(1) 实验①中铁较为活泼,为负极,铜为正极,导线中电子流向为 $ {\rm \mathrm{A}\to \mathrm{B}} $ 。
(2) 实验④的导线中电流由 $ {\rm \mathrm{A}} $ 极流向 $ {\rm \mathrm{B}} $ 极,则表明负极是铜电极,正极上 $ {\rm {\mathrm{N}\mathrm{O}}_{3}^{-}} $ 得到电子发生还原反应生成二氧化氮,电极反应式为 $ {\rm {\mathrm{N}\mathrm{O}}_{3}^{-}+{\mathrm{e}}^{-}+2{\mathrm{H}}^{+}\xlongequal{}{\mathrm{N}\mathrm{O}}_{2}↑+{\mathrm{H}}_{2}\mathrm{O}} $ 。
(3) 实验③中苯不是电解质溶液,电流计没有发生偏转,故烧杯中的液体必须是电解质溶液, $ \mathrm{a} $ 正确;实验④中铁较为活泼,但铁作正极, $ \mathrm{b} $ 错误;钢铁在潮湿的空气中会形成碳铁原电池而被腐蚀, $ \mathrm{c} $ 错误;实验①中铁作负极、铜作正极,实验④中铁作正极、铜作负极,故利用原电池电极反应判断金属活动性顺序时应注意选择合适的介质, $ \mathrm{d} $ 正确。
(4) 钠与盐酸反应生成氯化钠和氢气,离子方程式为 $ {\rm 2\mathrm{N}\mathrm{a}+2{\mathrm{H}}^{+}\xlongequal{}2{\mathrm{N}\mathrm{a}}^{+}+{\mathrm{H}}_{2}↑} $ 。
(5) 燃烧需要达到可燃物的着火点,实验⑥中钠燃烧能说明钠与盐酸反应放热。
(6) 由表格数据可知,在题述实验中,盐酸浓度越大,钠完全消失所用的时间越长。
(7) 实验⑩中钠完全消失所用的时间最长,反应速率最慢,原因可能是生成的氯化钠减小了钠与盐酸的接触面积,导致反应速率降低。




![]()



