第八章素养检测
一、刷速度
1.以下不符合“绿色发展,保护生态环境”理念的是( )
A. 含酶洗衣粉代替含磷洗衣粉
B. 化工生产过程中“先污染,后治理”
C. 用秸秆、粪便生产沼气,实现垃圾资源化
D. 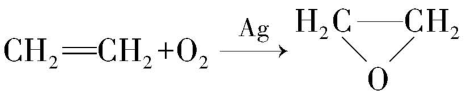 实现原子利用率 $ 100\% $
实现原子利用率 $ 100\% $
答案:B
解析:含酶洗衣粉代替含磷洗衣粉可减少水体富营养化, $ {\rm \mathrm{A}} $ 不符合题意;绿色化学核心思想是从源头减少或消除环境污染, $ {\rm \mathrm{B}} $ 符合题意;植物秸秆、粪便含有生物质能,可通过发酵制取沼气,从而有效利用生物质能,实现垃圾资源化, $ {\rm \mathrm{C}} $ 不符合题意;反应中产物只有一种,实现了原子利用率 $ 100\% $ ,符合绿色化学理念, $ {\rm \mathrm{D}} $ 不符合题意。
2.下列操作与所述化学知识没有关联的是( )
选项 | 操作 | 化学知识 |
A | 在家炒菜并添加碘盐 | 碘盐中的 $ {\rm {\mathrm{K}\mathrm{I}\mathrm{O}}_{3}} $ 为人体提供需要的碘元素 |
B | 自来水厂用 $ {\rm {\mathrm{C}\mathrm{l}}_{2}} $ 消毒杀菌 | $ {\rm {\mathrm{C}\mathrm{l}}_{2}} $ 具有强氧化性 |
C | 做馒头和面时添加 $ {\rm {\mathrm{N}\mathrm{a}\mathrm{H}\mathrm{C}\mathrm{O}}_{3}} $ | $ {\rm {\mathrm{N}\mathrm{a}\mathrm{H}\mathrm{C}\mathrm{O}}_{3}} $ 受热易分解产生 $ {\rm {\mathrm{C}\mathrm{O}}_{2}} $ |
D | 用厨余垃圾制农家肥 | 厨余垃圾含 $ {\rm \mathrm{N}} $ 、 $ {\rm \mathrm{P}} $ 等元素 |
解析:碘盐中添加 $ {\rm {\mathrm{K}\mathrm{I}\mathrm{O}}_{3}} $ ,为人体提供需要的碘元素, $ {\rm \mathrm{A}} $ 正确;自来水厂用 $ {\rm {\mathrm{C}\mathrm{l}}_{2}} $ 消毒杀菌,实际是利用 $ {\rm {\mathrm{C}\mathrm{l}}_{2}} $ 与水反应生成的 $ {\rm \mathrm{H}\mathrm{C}\mathrm{l}\mathrm{O}} $ 的强氧化性消毒杀菌, $ {\rm \mathrm{B}} $ 错误; $ {\rm {\mathrm{N}\mathrm{a}\mathrm{H}\mathrm{C}\mathrm{O}}_{3}} $ 受热易分解产生 $ {\rm {\mathrm{C}\mathrm{O}}_{2}} $ ,使馒头松软、多孔, $ {\rm \mathrm{C}} $ 正确;厨余垃圾中含 $ {\rm \mathrm{N}} $ 、 $ {\rm \mathrm{P}} $ 、 $ {\rm \mathrm{K}} $ 等元素, $ {\rm \mathrm{D}} $ 正确。
3.有关煤的综合利用如图所示,下列说法正确的是( )
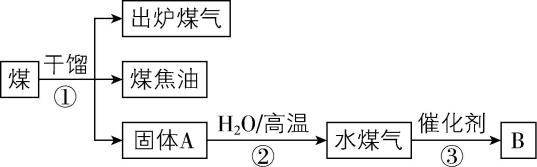
A. 煤焦油是纯净物
B. 煤是贮存于地下的可再生化石能源
C. ②为煤的气化过程,产物中不含 $ {\rm \mathrm{C}\mathrm{O}} $
D. B为甲醇或乙酸时,原子利用率均达到 $ 100\% $
答案:D
解析:煤焦油是由苯、甲苯、二甲苯、萘、酚类等物质组成的混合物, $ {\rm \mathrm{A}} $ 错误;煤属于不可再生能源, $ {\rm \mathrm{B}} $ 错误;②为煤的气化过程,焦炭与水蒸气在高温下的反应产物有 $ {\rm \mathrm{C}\mathrm{O}} $ 、 $ {\rm {\mathrm{H}}_{2}} $ , $ {\rm \mathrm{C}} $ 错误;水煤气的主要成分为 $ {\rm \mathrm{C}\mathrm{O}} $ 和 $ {\rm {\mathrm{H}}_{2}} $ , $ {\rm \mathrm{B}} $ 为 $ {\rm {\mathrm{C}\mathrm{H}}_{3}\mathrm{O}\mathrm{H}} $ 或 $ {\rm {\mathrm{C}\mathrm{H}}_{3}\mathrm{C}\mathrm{O}\mathrm{O}\mathrm{H}} $ 时,③中发生的反应为 $ {\rm \mathrm{C}\mathrm{O}+2{\mathrm{H}}_{2}{\xrightarrow[ ~]{催化剂}}{\mathrm{C}\mathrm{H}}_{3}\mathrm{O}\mathrm{H}} $ 或 $ {\rm 2\mathrm{C}\mathrm{O}+2{\mathrm{H}}_{2}{\xrightarrow[ ~]{催化剂}}{\mathrm{C}\mathrm{H}}_{3}\mathrm{C}\mathrm{O}\mathrm{O}\mathrm{H}} $ ,生成物均只有1种,原子利用率均达到 $ 100\% $ , $ {\rm \mathrm{D}} $ 正确。
4.下列说法不正确的是( )
A. 碳酸钠有碱性,可用作食用碱
B. 碳酸氢铵受热分解能产生大量气体,可用作食品膨松剂
C. 碳酸钙能与胃酸反应,可用作抗酸药,也可作营养强化剂
D. 谷氨酸钠通过增强鲜味发挥作用,可作增味剂
答案:D
解析:碳酸钠有碱性,可用作食用碱, $ {\rm \mathrm{A}} $ 正确;碳酸氢铵受热分解放出气体,常用作食品膨松剂, $ {\rm \mathrm{B}} $ 正确;碳酸钙能够和胃酸(盐酸)反应,生成钙离子,可用作抗酸药,也可作营养强化剂, $ {\rm \mathrm{C}} $ 正确;谷氨酸钠(味精)可以增强食品鲜味,可作增味剂, $ {\rm \mathrm{D}} $ 错误。
5.化学与生活息息相关,下列说法错误的是( )
A. 食品中添加适量的二氧化硫可以起到漂白、防腐和抗氧化等作用
B. 波尔多液是用胆矾、生石灰和水混合制成的一种常见的农药
C. 光导纤维在信息产业中应用广泛,制造光导纤维的主要材料是单质硅
D. 正常雨水由于溶解了二氧化碳,其 $ {\rm \mathrm{p}\mathrm{H}} $ 约为 $ 5.6 $ ,而酸雨的 $ {\rm \mathrm{p}\mathrm{H}} $ 小于5.6
答案:C
解析:二氧化硫具有杀菌消毒、抗氧化和漂白的能力,食品中添加适量的二氧化硫可以起到漂白、防腐和抗氧化的作用,但要在规定的范围内使用,控制好用量, $ {\rm \mathrm{A}} $ 正确;波尔多液由胆矾、生石灰和水混合制成,是一种常用的农药, $ {\rm \mathrm{B}} $ 正确;制造光导纤维的主要材料是二氧化硅, $ {\rm \mathrm{C}} $ 错误;正常雨水由于溶解了二氧化碳,其 $ {\rm \mathrm{p}\mathrm{H}} $ 约为 $ 5.6 $ ,当雨水的 $ {\rm \mathrm{p}\mathrm{H}} $ 小于5.6时为酸雨, $ {\rm \mathrm{D}} $ 正确。
6.我国古代“药金”的冶炼方法是将炉甘石 $ {\rm ({\mathrm{Z}\mathrm{n}\mathrm{C}\mathrm{O}}_{3}} $ , $ 350℃ $ 分解 $ ) $ 和赤铜矿 $ {\rm ({\mathrm{C}\mathrm{u}}_{2}\mathrm{O})} $ 与木炭按一定的比例混合后加热至 $ 800℃ $ ,即可炼出闪烁似金子般光泽的“药金”。下列叙述正确的是( )
A. “药金”实质上是铜锌合金
B. 冶炼炉中炉甘石直接被木炭还原为锌
C. 用王水可区别黄金和“药金”
D. 用火焰灼烧不能区别黄金和“药金”
答案:A
解析:冶炼“药金”时, $ {\rm {\mathrm{Z}\mathrm{n}\mathrm{C}\mathrm{O}}_{3}} $ 先发生分解反应: $ {\rm {\mathrm{Z}\mathrm{n}\mathrm{C}\mathrm{O}}_{3}\xlongequal{高温}\mathrm{Z}\mathrm{n}\mathrm{O}+{\mathrm{C}\mathrm{O}}_{2}↑} $ ,然后 $ {\rm \mathrm{Z}\mathrm{n}\mathrm{O}} $ 和 $ {\rm {\mathrm{C}\mathrm{u}}_{2}\mathrm{O}} $ 分别被 $ {\rm \mathrm{C}} $ 还原为锌、铜,从而得到“药金”, $ {\rm \mathrm{A}} $ 正确、 $ {\rm \mathrm{B}} $ 错误;王水可以溶解黄金和“药金”, $ {\rm \mathrm{C}} $ 错误;用火焰灼烧可以区别黄金和“药金”,因为高温下黄金跟空气不反应,而“药金”可以与空气反应,生成的 $ {\rm \mathrm{C}\mathrm{u}\mathrm{O}} $ 是黑色的, $ {\rm \mathrm{Z}\mathrm{n}\mathrm{O}} $ 是白色的,总之,灼烧后的“药金”颜色有变化, $ {\rm \mathrm{D}} $ 错误。
7.某制镁工厂生产剖面如图所示。下列有关说法中全部正确的一组是( )
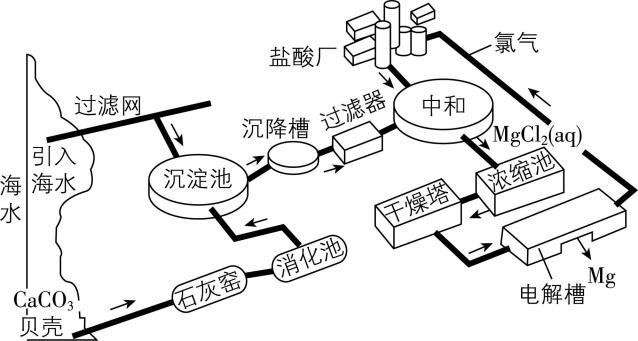
①“消化池”中有消石灰生成
②“中和”反应的离子方程式为 $ {\rm {\mathrm{H}}^{+}+{\mathrm{O}\mathrm{H}}^{-}\xlongequal{}{\mathrm{H}}_{2}\mathrm{O}} $
③盐酸厂制氯化氢时氢气在氯气中燃烧发出黄绿色火焰
④将氯气输送到盐酸厂可使用干燥的钢瓶
⑤“过滤器”中的母液中含有 $ {\rm {\mathrm{C}\mathrm{a}\mathrm{C}\mathrm{l}}_{2}} $
A. ①③④
B. ②④⑤
C. ①④⑤
D. ②③④
答案:C
解析:根据思路导引知,“消化池”中有消石灰生成,①正确;“中和”反应为氢氧化镁与盐酸反应,离子方程式为 $ {\rm 2{\mathrm{H}}^{+}+\mathrm{M}\mathrm{g}(\mathrm{O}\mathrm{H})_{2}\xlongequal{}2{\mathrm{H}}_{2}\mathrm{O}+{\mathrm{M}\mathrm{g}}^{2+}} $ ,②错误;盐酸厂制氯化氢时氢气在氯气中燃烧发出苍白色火焰,③错误;干燥的氯气与钢瓶不反应,干燥的钢瓶可以盛放氯气,④正确;“过滤器”中的母液中有氢氧化钙与氯化镁在“沉淀池”反应生成的 $ {\rm {\mathrm{C}\mathrm{a}\mathrm{C}\mathrm{l}}_{2}} $ ,⑤正确;故选 $ {\rm \mathrm{C}} $ 。
8.工业上获得金属材料的方法多种多样,获取几种常见金属单质的方法如图所示,下列有关说法正确的是( )
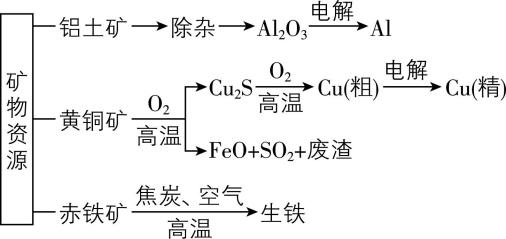
A. 可用 $ {\rm {\mathrm{A}\mathrm{l}\mathrm{C}\mathrm{l}}_{3}} $ 代替 $ {\rm {\mathrm{A}\mathrm{l}}_{2}{\mathrm{O}}_{3}} $ 电解制备金属铝
B. 炼铁高炉中焦炭将赤铁矿还原为生铁
C. 由 $ {\rm {\mathrm{C}\mathrm{u}}_{2}\mathrm{S}} $ 获取粗铜时,通入过量氧气有利于提高产量
D. 黄铜矿冶炼铜时,副产物 $ {\rm {\mathrm{S}\mathrm{O}}_{2}} $ 可用于生产硫酸, $ {\rm \mathrm{F}\mathrm{e}\mathrm{O}} $ 可用作冶炼铁的原料
答案:D
解析:氯化铝是共价化合物,熔融状态不导电,不能用氯化铝代替氧化铝电解制备金属铝, $ {\rm \mathrm{A}} $ 错误;炼铁高炉中焦炭与空气中的氧气高温条件下反应生成二氧化碳,进一步反应生成一氧化碳,一氧化碳高温条件下将赤铁矿还原为生铁, $ {\rm \mathrm{B}} $ 错误;由硫化亚铜获取粗铜时通入过量氧气,过量的氧气高温下会将反应生成的铜氧化为氧化铜,降低铜的产量, $ {\rm \mathrm{C}} $ 错误;黄铜矿冶炼铜时,副产物二氧化硫是制备硫酸的原料,可以用于生产硫酸,氧化亚铁是炼铁的原料,可以用于炼铁, $ {\rm \mathrm{D}} $ 正确。
9.环氧乙烷是一种重要的有机合成原料。
旧的合成方法是 $ {\rm {\mathrm{C}\mathrm{H}}_{2}\xlongequal{}{\mathrm{C}\mathrm{H}}_{2}+{\mathrm{C}\mathrm{l}}_{2}+{\mathrm{H}}_{2}\mathrm{O}\to {\mathrm{C}\mathrm{l}\mathrm{C}\mathrm{H}}_{2}{\mathrm{C}\mathrm{H}}_{2}\mathrm{O}\mathrm{H}+\mathrm{H}\mathrm{C}\mathrm{l}} $ ,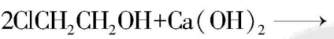
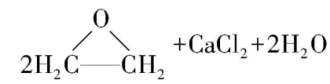 。
。
新的合成方法是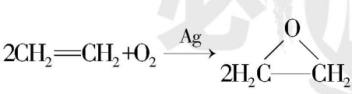 。
。
新、旧方法对比,下列说法错误的是( )
A. 旧方法对环境污染大
B. 新方法原料更易得
C. 新方法原子利用率高
D. 新、旧方法对设备的腐蚀性都小
答案:D
解析:旧方法使用 $ {\rm {\mathrm{C}\mathrm{l}}_{2}} $ 作原料,对环境污染大, $ {\rm \mathrm{A}} $ 正确;与 $ {\rm {\mathrm{C}\mathrm{l}}_{2}} $ 相比较, $ {\rm {\mathrm{O}}_{2}} $ 更易得, $ {\rm \mathrm{B}} $ 正确;旧方法中除生成环氧乙烷外,还生成 $ {\rm \mathrm{H}\mathrm{C}\mathrm{l}} $ 、 $ {\rm {\mathrm{H}}_{2}\mathrm{O}} $ 等,原子利用率小于 $ 100\% $ ,新方法原子利用率理论上是 $ 100\% $ ,比旧方法高, $ {\rm \mathrm{C}} $ 正确;旧方法生成 $ {\rm \mathrm{H}\mathrm{C}\mathrm{l}} $ ,对设备有腐蚀性, $ {\rm \mathrm{D}} $ 错误。
10.滴滴涕 $ {\rm (\mathrm{D}\mathrm{D}\mathrm{T})} $ 是一种有机氯杀虫剂,因其性质稳定,具有较好的杀虫效果而被大量使用,以致最终造成环境污染。另外,如果长期施用 $ {\rm \mathrm{D}\mathrm{D}\mathrm{T}} $ ,一些害虫体内的酶会使 $ {\rm \mathrm{D}\mathrm{D}\mathrm{T}} $ 发生反应变成 $ {\rm \mathrm{D}\mathrm{D}\mathrm{E}} $ (如图),害虫就具有了对 $ {\rm \mathrm{D}\mathrm{D}\mathrm{T}} $ 的抗药性。
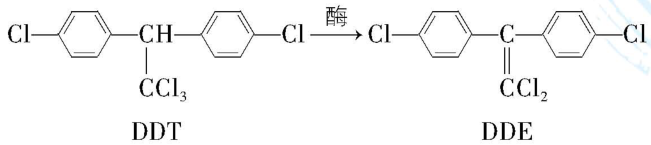
请回答:
(1) $ {\rm \mathrm{D}\mathrm{D}\mathrm{T}} $ 中官能团的名称是 。
(2) $ {\rm \mathrm{D}\mathrm{D}\mathrm{E}} $ 的分子式是 。
(3) 下列说法正确的是 (填序号)。
A. $ {\rm \mathrm{D}\mathrm{D}\mathrm{T}} $ 是一种易溶于水的物质
B. $ {\rm \mathrm{D}\mathrm{D}\mathrm{T}} $ 在杀死害虫的同时,也对其他生物有害
C. 含 $ {\rm \mathrm{D}\mathrm{D}\mathrm{T}} $ 的农药用于蔬菜杀虫时,在蔬菜中残留时间短,对人体无害
D. 可以用溴水鉴别 $ {\rm \mathrm{D}\mathrm{D}\mathrm{T}} $ 、 $ {\rm \mathrm{D}\mathrm{D}\mathrm{E}} $
(4) $ {\rm \mathrm{D}\mathrm{D}\mathrm{T}} $ 转化成 $ {\rm \mathrm{D}\mathrm{D}\mathrm{E}} $ 的同时还生成一种常见的无机物,请写出该反应的化学方程式: 。
答案:(1) 碳氯键
(2) $ {\rm {\mathrm{C}}_{14}{\mathrm{H}}_{8}{\mathrm{C}\mathrm{l}}_{4}} $
(3) BD
(4) 

解析:(1) $ {\rm \mathrm{D}\mathrm{D}\mathrm{T}} $ 中的官能团是碳氯键。
(2) 根据 $ {\rm \mathrm{C}} $ 、 $ {\rm \mathrm{H}} $ 、 $ {\rm \mathrm{C}\mathrm{l}} $ 的成键特点, $ {\rm \mathrm{D}\mathrm{D}\mathrm{E}} $ 的分子式为 $ {\rm {\mathrm{C}}_{14}{\mathrm{H}}_{8}{\mathrm{C}\mathrm{l}}_{4}} $ 。
(3) $ {\rm \mathrm{D}\mathrm{D}\mathrm{T}} $ 是卤代烃,易溶于有机溶剂,难溶于水, $ {\rm \mathrm{A}} $ 错误; $ {\rm \mathrm{D}\mathrm{D}\mathrm{T}} $ 性质稳定,难溶于水,易溶于脂肪,大量施用后会长期存在于自然界中而难以降解,并通过食物链富集在动物的脂肪中,从而对鸟类等昆虫的天敌产生慢性毒害, $ {\rm \mathrm{B}} $ 正确;由于 $ {\rm \mathrm{D}\mathrm{D}\mathrm{T}} $ 性质稳定,所以用于蔬菜杀虫时能在蔬菜中较长时间残留, $ {\rm \mathrm{C}} $ 错误; $ {\rm \mathrm{D}\mathrm{D}\mathrm{T}} $ 不能与溴水反应,不能使溴水褪色, $ {\rm \mathrm{D}\mathrm{D}\mathrm{E}} $ 含有碳碳双键,能与溴水中的溴单质反应而使溴水褪色,所以可以用溴水鉴别 $ {\rm \mathrm{D}\mathrm{D}\mathrm{T}} $ 、 $ {\rm \mathrm{D}\mathrm{D}\mathrm{E}} $ , $ {\rm \mathrm{D}} $ 正确。
(4) 由于 $ {\rm \mathrm{D}\mathrm{D}\mathrm{T}} $ 转化成 $ {\rm \mathrm{D}\mathrm{D}\mathrm{E}} $ 时还生成一种常见的无机物,根据元素守恒、原子守恒,反应的化学方程式为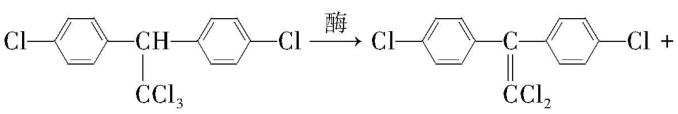
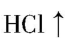 。
。
11.以铝土矿(主要成分为 $ {\rm {\mathrm{A}\mathrm{l}}_{2}{\mathrm{O}}_{3}} $ ,含 $ {\rm {\mathrm{S}\mathrm{i}\mathrm{O}}_{2}} $ 和铁的氧化物等杂质)为原料制备铝与硫酸亚铁,工艺流程如下所示,请回答下列问题:
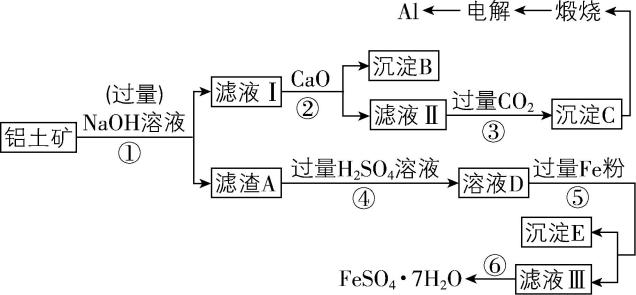
(1) 步骤①中提高碱浸速率的方法是 (任写一条)。
(2) 滤液Ⅰ中主要的阴离子是 $ {\rm {\mathrm{S}\mathrm{i}\mathrm{O}}_{3}^{2-}} $ 和 。
(3) 写出步骤③生成沉淀C的化学方程式: 。
(4) 步骤⑤加入过量铁粉的目的是 (用离子方程式解释)
(5) 检验滤液Ⅲ中的金属阳离子的方法是 。
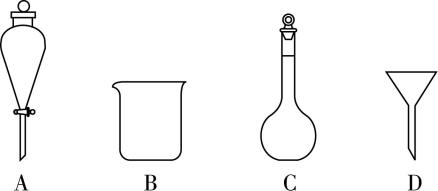
(6) 滤液Ⅲ经过 (实验操作)、过滤、洗涤、干燥得到硫酸亚铁晶体,过滤时需要的玻璃仪器有 (填序号)。
答案:(1) 粉碎铝土矿、适当升高温度等(任写一条,合理即可)
(2) $ {\rm {\mathrm{O}\mathrm{H}}^{-}} $ 、 $ {\rm [\mathrm{A}\mathrm{l} (\mathrm{O}\mathrm{H})_{4}{ ]}^{-}} $
(3) $ {\rm \mathrm{N}\mathrm{a} [\mathrm{A}\mathrm{l} (\mathrm{O}\mathrm{H})_{4} ]+{\mathrm{C}\mathrm{O}}_{2}\xlongequal{}\mathrm{A}\mathrm{l} (\mathrm{O}\mathrm{H})_{3}↓+{\mathrm{N}\mathrm{a}\mathrm{H}\mathrm{C}\mathrm{O}}_{3}} $
(4) $ {\rm \mathrm{F}\mathrm{e}+2{\mathrm{F}\mathrm{e}}^{3+}\xlongequal{}3{\mathrm{F}\mathrm{e}}^{2+}} $
(5) 取滤液Ⅲ少许于试管中,加入 $ {\rm \mathrm{K}\mathrm{S}\mathrm{C}\mathrm{N}} $ 溶液,无现象,再通入 $ {\rm {\mathrm{C}\mathrm{l}}_{2}} $ ,溶液变为红色
(6) 蒸发浓缩、冷却结晶; $ {\rm \mathrm{B}\mathrm{D}} $
解析:(1) 为提高碱浸速率,可粉碎铝土矿以增大其与 $ {\rm \mathrm{N}\mathrm{a}\mathrm{O}\mathrm{H}} $ 溶液的接触面积、适当升高温度等。
(2) 由思路导引可知滤液Ⅰ中主要的阴离子是 $ {\rm [\mathrm{A}\mathrm{l} (\mathrm{O}\mathrm{H})_{4}{ ]}^{-}} $ 、 $ {\rm {\mathrm{O}\mathrm{H}}^{-}} $ 、 $ {\rm {\mathrm{S}\mathrm{i}\mathrm{O}}_{3}^{2-}} $ 。
(3) 步骤③中二氧化碳过量,反应生成氢氧化铝沉淀和碳酸氢钠,化学方程式为 $ {\rm \mathrm{N}\mathrm{a} [\mathrm{A}\mathrm{l} (\mathrm{O}\mathrm{H})_{4} ]+{\mathrm{C}\mathrm{O}}_{2}\xlongequal{}\mathrm{A}\mathrm{l} (\mathrm{O}\mathrm{H})_{3}↓+{\mathrm{N}\mathrm{a}\mathrm{H}\mathrm{C}\mathrm{O}}_{3}} $ 。
(4) 步骤⑤加入过量铁粉的目的是将 $ {\rm {\mathrm{F}\mathrm{e}}^{3+}} $ 全部还原为 $ {\rm {\mathrm{F}\mathrm{e}}^{2+}} $ ,除去铁离子,反应的离子方程式为 $ {\rm \mathrm{F}\mathrm{e}+2{\mathrm{F}\mathrm{e}}^{3+}\xlongequal{}3{\mathrm{F}\mathrm{e}}^{2+}} $ 。
(5) 滤液Ⅲ中的金属阳离子为亚铁离子,检验方法是取滤液Ⅲ少许于试管中,加入 $ {\rm \mathrm{K}\mathrm{S}\mathrm{C}\mathrm{N}} $ 溶液,无现象,再通入 $ {\rm {\mathrm{C}\mathrm{l}}_{2}} $ ,溶液变为红色。
(6) 滤液Ⅲ经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到硫酸亚铁晶体,过滤时需要的玻璃仪器有烧杯、漏斗、玻璃棒,故选 $ {\rm \mathrm{B}\mathrm{D}} $ 。
12.钼酸钠 $ {\rm ({\mathrm{N}\mathrm{a}}_{2}{\mathrm{M}\mathrm{o}\mathrm{O}}_{4})} $ 具有广泛的用途,可作新型阻燃剂、水处理剂和无公害型冷却水系统的金属缓蚀剂等。回答下列问题:
Ⅰ.工业通过钼精矿(主要成分 $ {\rm {\mathrm{M}\mathrm{o}\mathrm{S}}_{2}} $ 中硫为 $ -2 $ 价)制备钼酸钠晶体的流程如下所示。
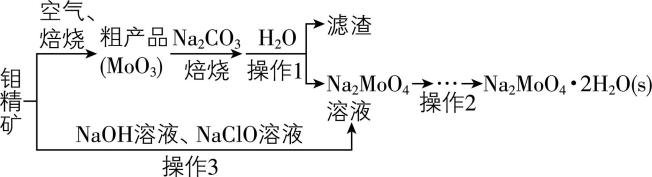
(1) 通入空气焙烧钼精矿时,会产生一种有毒气体,工业上使用足量氨水吸收,用化学方程式解释原因: 。
(2) 写出粗产品焙烧的化学方程式: 。
(3) 实验室进行操作1所用的玻璃仪器是烧杯、 、 ,操作2的步骤是 、 、过滤、洗涤、干燥。
(4) 操作3中硫元素被氧化为最高价,发生反应的离子方程式为 。
Ⅱ.为实现绿色化学,也可从废钼催化剂(主要成分为 $ {\rm {\mathrm{M}\mathrm{o}\mathrm{O}}_{3}} $ 、 $ {\rm {\mathrm{A}\mathrm{l}}_{2}{\mathrm{O}}_{3}} $ 、 $ {\rm {\mathrm{F}\mathrm{e}}_{2}{\mathrm{O}}_{3}} $ 等)中回收 $ {\rm {\mathrm{N}\mathrm{a}}_{2}{\mathrm{M}\mathrm{o}\mathrm{O}}_{4}} $ 和 $ {\rm \mathrm{A}\mathrm{l}(\mathrm{O}\mathrm{H})_{3}} $ ,其工艺流程如下:
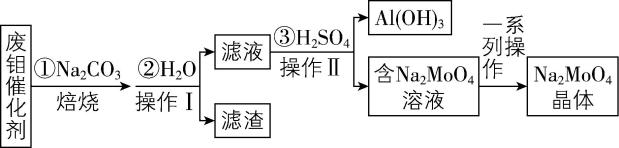
(5) 检验操作Ⅰ后所得的滤液中含有 $ {\rm {\mathrm{N}\mathrm{a}}^{+}} $ 的实验方法是 。
(6) ③中加入的 $ {\rm {\mathrm{H}}_{2}{\mathrm{S}\mathrm{O}}_{4}} $ 需适量,用离子方程式说明原因: (不考虑对 $ {\rm {\mathrm{M}\mathrm{o}\mathrm{O}}_{4}^{2-}} $ 的影响)。
答案:(1) $ {\rm 2{\mathrm{N}\mathrm{H}}_{3}+{\mathrm{H}}_{2}\mathrm{O}+{\mathrm{S}\mathrm{O}}_{2}\xlongequal{}({\mathrm{N}\mathrm{H}}_{4})_{2}{\mathrm{S}\mathrm{O}}_{3}} $
(2) $ {\rm {\mathrm{M}\mathrm{o}\mathrm{O}}_{3}+{\mathrm{N}\mathrm{a}}_{2}{\mathrm{C}\mathrm{O}}_{3}\xlongequal{焙烧}{\mathrm{N}\mathrm{a}}_{2}{\mathrm{M}\mathrm{o}\mathrm{O}}_{4}+{\mathrm{C}\mathrm{O}}_{2}↑} $
(3) 漏斗;玻璃棒;蒸发浓缩;冷却结晶
(4) $ {\rm {\mathrm{M}\mathrm{o}\mathrm{S}}_{2}+6{\mathrm{O}\mathrm{H}}^{-}+9{\mathrm{C}\mathrm{l}\mathrm{O}}^{-}\xlongequal{}{\mathrm{M}\mathrm{o}\mathrm{O}}_{4}^{2-}+2{\mathrm{S}\mathrm{O}}_{4}^{2-}+9{\mathrm{C}\mathrm{l}}^{-}+3{\mathrm{H}}_{2}\mathrm{O}} $
(5) 将熔嵌在玻璃棒上的铂丝在酒精灯外焰上灼烧,至与原来的火焰颜色相同为止;用铂丝蘸取滤液,放在酒精灯外焰上灼烧,火焰呈黄色,说明滤液中含有 $ {\rm {\mathrm{N}\mathrm{a}}^{+}} $
(6) $ {\rm \mathrm{A}\mathrm{l}(\mathrm{O}\mathrm{H})_{3}+3{\mathrm{H}}^{+}\xlongequal{}{\mathrm{A}\mathrm{l}}^{3+}+3{\mathrm{H}}_{2}\mathrm{O}} $
解析:(1) 由思路导引可知,通入空气焙烧钼精矿时产生的有毒气体为 $ {\rm {\mathrm{S}\mathrm{O}}_{2}} $ ,工业上使用足量氨水吸收 $ {\rm {\mathrm{S}\mathrm{O}}_{2}} $ ,反应的化学方程式为 $ {\rm 2{\mathrm{N}\mathrm{H}}_{3}+{\mathrm{H}}_{2}\mathrm{O}+{\mathrm{S}\mathrm{O}}_{2}\xlongequal{}({\mathrm{N}\mathrm{H}}_{4})_{2}{\mathrm{S}\mathrm{O}}_{3}} $ 。
(2) $ {\rm {\mathrm{M}\mathrm{o}\mathrm{O}}_{3}} $ 和 $ {\rm {\mathrm{N}\mathrm{a}}_{2}{\mathrm{C}\mathrm{O}}_{3}} $ 混合焙烧,得到 $ {\rm {\mathrm{N}\mathrm{a}}_{2}{\mathrm{M}\mathrm{o}\mathrm{O}}_{4}} $ 和二氧化碳,化学方程式为 $ {\rm {\mathrm{M}\mathrm{o}\mathrm{O}}_{3}+{\mathrm{N}\mathrm{a}}_{2}{\mathrm{C}\mathrm{O}}_{3}\xlongequal{焙烧}{\mathrm{N}\mathrm{a}}_{2}{\mathrm{M}\mathrm{o}\mathrm{O}}_{4}+{\mathrm{C}\mathrm{O}}_{2}↑} $ 。
(3) 操作1为过滤,所用的玻璃仪器是烧杯、漏斗、玻璃棒,操作2是从溶液中析出晶体,具体的操作步骤是蒸发浓缩、冷却结晶、过滤、洗涤、干燥。
(4) 操作3中 $ {\rm {\mathrm{M}\mathrm{o}\mathrm{S}}_{2}} $ 和 $ {\rm \mathrm{N}\mathrm{a}\mathrm{O}\mathrm{H}} $ 、 $ {\rm \mathrm{N}\mathrm{a}\mathrm{C}\mathrm{l}\mathrm{O}} $ 反应生成 $ {\rm {\mathrm{N}\mathrm{a}}_{2}{\mathrm{M}\mathrm{o}\mathrm{O}}_{4}} $ ,硫元素被氧化为最高价, $ {\rm \mathrm{M}\mathrm{o}} $ 由 $ +4 $ 价升高到 $ +6 $ 价, $ {\rm \mathrm{N}\mathrm{a}\mathrm{C}\mathrm{l}\mathrm{O}} $ 被还原为 $ {\rm \mathrm{N}\mathrm{a}\mathrm{C}\mathrm{l}} $ ,由得失电子守恒、原子守恒和电荷守恒可得反应的离子方程式: $ {\rm {\mathrm{M}\mathrm{o}\mathrm{S}}_{2}+6{\mathrm{O}\mathrm{H}}^{-}+9{\mathrm{C}\mathrm{l}\mathrm{O}}^{-}\xlongequal{}{\mathrm{M}\mathrm{o}\mathrm{O}}_{4}^{2-}+2{\mathrm{S}\mathrm{O}}_{4}^{2-}+9{\mathrm{C}\mathrm{l}}^{-}+3{\mathrm{H}}_{2}\mathrm{O}} $ 。
(5) 检验滤液中含有钠离子,可以用焰色试验,如果焰色呈黄色则说明滤液中含有钠离子,操作方法见答案。
(6) ③中加入的 $ {\rm {\mathrm{H}}_{2}{\mathrm{S}\mathrm{O}}_{4}} $ 需适量,避免氢氧化铝溶解,离子方程式为 $ {\rm \mathrm{A}\mathrm{l}(\mathrm{O}\mathrm{H})_{3}+3{\mathrm{H}}^{+}\xlongequal{}{\mathrm{A}\mathrm{l}}^{3+}+3{\mathrm{H}}_{2}\mathrm{O}} $ 。
13.浩瀚的海洋里蕴藏着丰富的化学资源,利用海水可以提取溴和镁,提取过程如下:
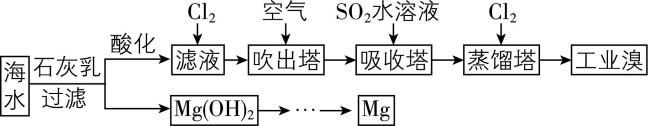
(1) 海水制得的粗盐中含有泥沙、 $ {\rm {\mathrm{C}\mathrm{a}\mathrm{C}\mathrm{l}}_{2}} $ 、 $ {\rm {\mathrm{M}\mathrm{g}\mathrm{C}\mathrm{l}}_{2}} $ 以及可溶性硫酸盐等杂质,可以依次通过溶解、过滤、 (填序号,所加试剂均过量)、结晶等一系列流程得到精盐。
$ \mathrm{a} $ .加入 $ {\rm {\mathrm{N}\mathrm{a}}_{2}{\mathrm{C}\mathrm{O}}_{3}} $ 溶液 $ \to $ 加入 $ {\rm \mathrm{N}\mathrm{a}\mathrm{O}\mathrm{H}} $ 溶液 $ \to $ 加入 $ {\rm {\mathrm{B}\mathrm{a}\mathrm{C}\mathrm{l}}_{2}} $ 溶液 $ \to $ 过滤 $ \to $ 加入稀盐酸
$ \mathrm{b} $ .加入 $ {\rm \mathrm{N}\mathrm{a}\mathrm{O}\mathrm{H}} $ 溶液 $ \to $ 加入 $ {\rm {\mathrm{B}\mathrm{a}\mathrm{C}\mathrm{l}}_{2}} $ 溶液 $ \to $ 加入 $ {\rm {\mathrm{N}\mathrm{a}}_{2}{\mathrm{C}\mathrm{O}}_{3}} $ 溶液 $ \to $ 加入稀盐酸 $ \to $ 过滤
$ \mathrm{c} $ .加入 $ {\rm {\mathrm{B}\mathrm{a}\mathrm{C}\mathrm{l}}_{2}} $ 溶液 $ \to $ 加入 $ {\rm {\mathrm{N}\mathrm{a}}_{2}{\mathrm{C}\mathrm{O}}_{3}} $ 溶液 $ \to $ 加入 $ {\rm \mathrm{N}\mathrm{a}\mathrm{O}\mathrm{H}} $ 溶液 $ \to $ 过滤 $ \to $ 加入稀盐酸
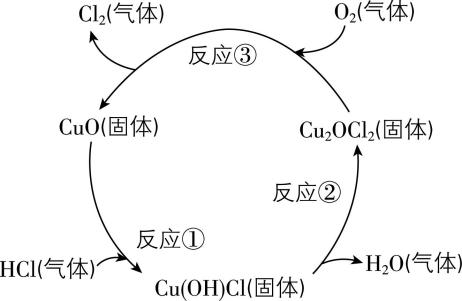
(2) 制备 $ {\rm {\mathrm{B}\mathrm{r}}_{2}} $ 的过程中需要用到大量 $ {\rm {\mathrm{C}\mathrm{l}}_{2}} $ 。如图是一种制备氯气的原理示意图,其反应物是 , $ {\rm \mathrm{C}\mathrm{u}\mathrm{O}} $ 的作用是 。
(3) “吹出法”是工业上常用的一种海水提溴技术。
① 经过2次 $ {\rm {\mathrm{B}\mathrm{r}}^{-}\to {\mathrm{B}\mathrm{r}}_{2}} $ ,转化的目的是 。
② 若在实验室蒸馏出溴单质,需控制温度在 $ 60℃ $ 左右,则宜采取的加热方式是 。
③ “吹出法”中的“吸收”及后续步骤的工艺也可采用如下流程:

写出步骤②中反应的离子方程式: 。
(4) 在实验中,欲利用获得的 $ {\rm \mathrm{M}\mathrm{g}(\mathrm{O}\mathrm{H})_{2}} $ 制取纯净的 $ {\rm {\mathrm{M}\mathrm{g}\mathrm{C}\mathrm{l}}_{2}\cdot 6{\mathrm{H}}_{2}\mathrm{O}} $ 晶体,请补充实验方案:取一定量 $ {\rm \mathrm{M}\mathrm{g}(\mathrm{O}\mathrm{H})_{2}} $ 固体置于烧杯中, ,低温干燥,得到 $ {\rm {\mathrm{M}\mathrm{g}\mathrm{C}\mathrm{l}}_{2}\cdot 6{\mathrm{H}}_{2}\mathrm{O}} $ 晶体(可选用试剂: $ {\rm 1\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}{\mathrm{H}}_{2}{\mathrm{S}\mathrm{O}}_{4}} $ 溶液、 $ {\rm 2\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}\mathrm{H}\mathrm{C}\mathrm{l}} $ 溶液、冰水)。
答案:(1) $ \mathrm{c} $
(2) $ {\rm \mathrm{H}\mathrm{C}\mathrm{l}} $ 、 $ {\rm {\mathrm{O}}_{2}} $ ;作催化剂
(3) ① 富集溴元素
② 水浴加热
③ $ {\rm 5{\mathrm{B}\mathrm{r}}^{-}+{\mathrm{B}\mathrm{r}\mathrm{O}}_{3}^{-}+6{\mathrm{H}}^{+}\xlongequal{}3{\mathrm{B}\mathrm{r}}_{2}+3{\mathrm{H}}_{2}\mathrm{O}} $
(4) 边搅拌边加入 $ {\rm 2\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}\mathrm{H}\mathrm{C}\mathrm{l}} $ 溶液至固体完全溶解,再蒸发浓缩、冷却结晶、过滤、冰水洗涤
解析:(1) 用过量 $ {\rm \mathrm{N}\mathrm{a}\mathrm{O}\mathrm{H}} $ 溶液除 $ {\rm {\mathrm{M}\mathrm{g}\mathrm{C}\mathrm{l}}_{2}} $ ,用过量 $ {\rm {\mathrm{B}\mathrm{a}\mathrm{C}\mathrm{l}}_{2}} $ 溶液除可溶性硫酸盐,用过量 $ {\rm {\mathrm{N}\mathrm{a}}_{2}{\mathrm{C}\mathrm{O}}_{3}} $ 溶液除 $ {\rm {\mathrm{C}\mathrm{a}\mathrm{C}\mathrm{l}}_{2}} $ ,为除去过量 $ {\rm {\mathrm{B}\mathrm{a}\mathrm{C}\mathrm{l}}_{2}} $ ,要在加入 $ {\rm {\mathrm{B}\mathrm{a}\mathrm{C}\mathrm{l}}_{2}} $ 溶液后再加 $ {\rm {\mathrm{N}\mathrm{a}}_{2}{\mathrm{C}\mathrm{O}}_{3}} $ 溶液,过滤出生成的沉淀,再加适量盐酸除去过量 $ {\rm \mathrm{N}\mathrm{a}\mathrm{O}\mathrm{H}} $ 和 $ {\rm {\mathrm{N}\mathrm{a}}_{2}{\mathrm{C}\mathrm{O}}_{3}} $ ,所以加试剂的顺序为加入 $ {\rm {\mathrm{B}\mathrm{a}\mathrm{C}\mathrm{l}}_{2}} $ 溶液 $ \to $ 加入 $ {\rm {\mathrm{N}\mathrm{a}}_{2}{\mathrm{C}\mathrm{O}}_{3}} $ 溶液 $ \to $ 加入 $ {\rm \mathrm{N}\mathrm{a}\mathrm{O}\mathrm{H}} $ 溶液 $ \to $ 过滤 $ \to $ 加入稀盐酸,选 $ \mathrm{c} $ 。
(2) 根据制备氯气的图示, $ {\rm \mathrm{H}\mathrm{C}\mathrm{l}} $ 和氧气反应生成水和氯气,其反应物是 $ {\rm \mathrm{H}\mathrm{C}\mathrm{l}} $ 和 $ {\rm {\mathrm{O}}_{2}} $ ; $ {\rm \mathrm{C}\mathrm{u}\mathrm{O}} $ 是在反应中先被消耗,最后再生成,所以 $ {\rm \mathrm{C}\mathrm{u}\mathrm{O}} $ 的作用是作催化剂。
(3) ① 经过2次 $ {\rm {\mathrm{B}\mathrm{r}}^{-}\to {\mathrm{B}\mathrm{r}}_{2}} $ ,转化的目的是使得海水中含量很低的溴元素得到富集。
② 为便于精确控制温度在 $ 60℃ $ 左右,宜采取的加热方式是水浴加热。
③ 步骤②中 $ {\rm {\mathrm{B}\mathrm{r}}^{-}} $ 、 $ {\rm {\mathrm{B}\mathrm{r}\mathrm{O}}_{3}^{-}} $ 在酸性条件下发生归中反应生成 $ {\rm {\mathrm{B}\mathrm{r}}_{2}} $ 单质,反应的离子方程式为 $ {\rm 5{\mathrm{B}\mathrm{r}}^{-}+{\mathrm{B}\mathrm{r}\mathrm{O}}_{3}^{-}+6{\mathrm{H}}^{+}\xlongequal{}3{\mathrm{B}\mathrm{r}}_{2}+3{\mathrm{H}}_{2}\mathrm{O}} $ 。
(4) $ {\rm \mathrm{M}\mathrm{g}(\mathrm{O}\mathrm{H})_{2}} $ 和盐酸反应生成氯化镁溶液,再经蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到 $ {\rm {\mathrm{M}\mathrm{g}\mathrm{C}\mathrm{l}}_{2}\cdot 6{\mathrm{H}}_{2}\mathrm{O}} $ 晶体,方案为取一定量 $ {\rm \mathrm{M}\mathrm{g}(\mathrm{O}\mathrm{H})_{2}} $ 固体置于烧杯中,边搅拌边加入 $ {\rm 2\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}\mathrm{H}\mathrm{C}\mathrm{l}} $ 溶液至固体完全溶解,再蒸发浓缩、冷却结晶、过滤、冰水洗涤,低温干燥,得到 $ {\rm {\mathrm{M}\mathrm{g}\mathrm{C}\mathrm{l}}_{2}\cdot 6{\mathrm{H}}_{2}\mathrm{O}} $ 晶体。
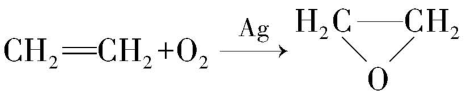 实现原子利用率 $ 100\% $
实现原子利用率 $ 100\% $ 


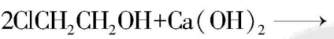
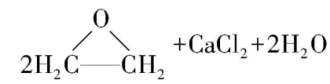 。
。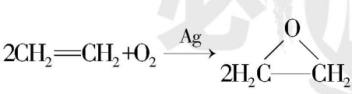 。
。









