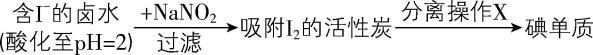2.煤、石油和天然气仍是人类使用的主要能源,下列有关说法正确的是( )
A. 煤的气化、液化都属于物理变化
B. 天然气作为化工原料主要用于合成氨和生产甲醇等
C. 石油经分馏得到的轻质油难以满足社会需求,需要通过裂解将重油转化为汽油等轻质油
D. 煤的气化是将煤隔绝空气加热到一定温度得到气体燃料的过程
答案:B
解析:煤的气化和液化过程中均有新物质生成,属于化学变化, $ {\rm \mathrm{A}} $ 错误;天然气作为化工原料主要用于合成氨和生产甲醇等, $ {\rm \mathrm{B}} $ 正确;通过催化裂化过程可以将重油裂化为汽油等轻质油, $ {\rm \mathrm{C}} $ 错误;煤的气化是将煤转化为可燃性气体的过程,主要是碳与水蒸气反应生成水煤气,不是将煤隔绝空气加热, $ {\rm \mathrm{D}} $ 错误。
3.海洋中蕴藏着大量的化学资源,海水的综合利用示意图如下,下列有关说法正确的是( )
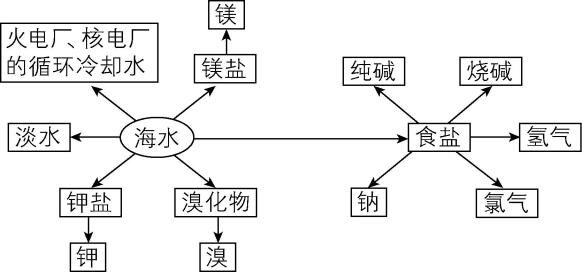
A. 海水提溴工艺中“吹出”和“吸收”两个步骤的目的是富集溴
B. 工业电解饱和食盐水制备金属钠与氯气
C. 向海水中先通入 $ {\rm {\mathrm{N}\mathrm{H}}_{3}} $ ,再通入 $ {\rm {\mathrm{C}\mathrm{O}}_{2}} $ 来制备纯碱
D. 利用高分子反渗透膜可将海水淡化,但是用传统的蒸馏法淡化更加节能
答案:A
解析:海水提溴的过程主要包括氧化、吹出、吸收、蒸馏等环节,先吹出再吸收,其目的是富集以提高溴的含量, $ {\rm \mathrm{A}} $ 正确;工业电解饱和食盐水制备氢氧化钠、氢气与氯气,电解熔融的氯化钠制备金属钠与氯气, $ {\rm \mathrm{B}} $ 错误;海水中氯化钠浓度太低,应向饱和食盐水中先通入 $ {\rm {\mathrm{N}\mathrm{H}}_{3}} $ 再通入 $ {\rm {\mathrm{C}\mathrm{O}}_{2}} $ 制得小苏打进而制备纯碱, $ {\rm \mathrm{C}} $ 错误;利用高分子反渗透膜可将海水淡化,相较于传统的蒸馏法淡化更加节能, $ {\rm \mathrm{D}} $ 错误。
4.从海水中提取镁、溴,主要流程如下。
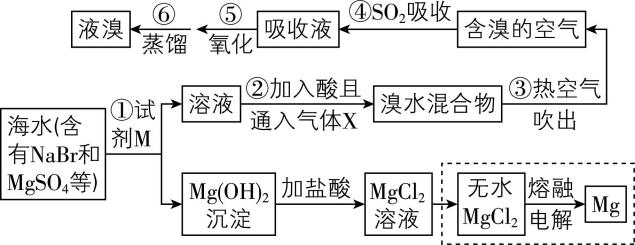
下列说法错误的是( )
A. 通入的气体 $ {\rm \mathrm{X}} $ 是 $ {\rm {\mathrm{C}\mathrm{l}}_{2}} $
B. 用 $ {\rm {\mathrm{S}\mathrm{O}}_{2}} $ 吸收吹出的溴,离子方程式为 $ {\rm {\mathrm{B}\mathrm{r}}_{2}+{\mathrm{S}\mathrm{O}}_{2}+2{\mathrm{H}}_{2}\mathrm{O}\xlongequal{}2{\mathrm{B}\mathrm{r}}^{-}+4{\mathrm{H}}^{+}+{\mathrm{S}\mathrm{O}}_{4}^{2-}} $
C. 将 $ {\rm {\mathrm{M}\mathrm{g}\mathrm{S}\mathrm{O}}_{4}} $ 转化成 $ {\rm \mathrm{M}\mathrm{g}(\mathrm{O}\mathrm{H})_{2}} $ 时,为了降低成本,试剂 $ {\rm \mathrm{M}} $ 最好选择 $ {\rm \mathrm{N}\mathrm{a}\mathrm{O}\mathrm{H}} $
D. 加入试剂 $ {\rm \mathrm{M}} $ 后,分离得到 $ {\rm \mathrm{M}\mathrm{g}(\mathrm{O}\mathrm{H})_{2}} $ 必须用到的玻璃仪器有烧杯、漏斗和玻璃棒
答案:C
解析:溶液中通入气体 $ {\rm \mathrm{X}} $ 得到溴水混合物,则 $ {\rm \mathrm{X}} $ 是 $ {\rm {\mathrm{C}\mathrm{l}}_{2}} $ , $ {\rm \mathrm{A}} $ 正确;用 $ {\rm {\mathrm{S}\mathrm{O}}_{2}} $ 吸收吹出的溴,反应生成硫酸和氢溴酸,反应的离子方程式为 $ {\rm {\mathrm{B}\mathrm{r}}_{2}+{\mathrm{S}\mathrm{O}}_{2}+2{\mathrm{H}}_{2}\mathrm{O}\xlongequal{}2{\mathrm{B}\mathrm{r}}^{-}+4{\mathrm{H}}^{+}+{\mathrm{S}\mathrm{O}}_{4}^{2-}} $ , $ {\rm \mathrm{B}} $ 正确;将 $ {\rm {\mathrm{M}\mathrm{g}\mathrm{S}\mathrm{O}}_{4}} $ 转化成 $ {\rm \mathrm{M}\mathrm{g}(\mathrm{O}\mathrm{H})_{2}} $ 时,为了降低成本,试剂 $ {\rm \mathrm{M}} $ 最好选择石灰乳, $ {\rm \mathrm{C}} $ 错误;加入试剂 $ {\rm \mathrm{M}} $ 后,用过滤法分离得到 $ {\rm \mathrm{M}\mathrm{g}(\mathrm{O}\mathrm{H})_{2}} $ ,必须用到的玻璃仪器有烧杯、漏斗和玻璃棒, $ {\rm \mathrm{D}} $ 正确。
5.海水是巨大的资源宝库。
Ⅰ.海带中含有碘元素,从海带中提取碘的实验过程如下所示:

(1) 步骤④中的氧化剂可使用 $ {\rm {\mathrm{C}\mathrm{l}}_{2}} $ ,发生反应的离子方程式为 。
(2) 步骤⑤中可用 $ {\rm {\mathrm{C}\mathrm{C}\mathrm{l}}_{4}} $ 作萃取剂,理由有 (填序号)。
$ {\rm \mathrm{a}.{\mathrm{C}\mathrm{C}\mathrm{l}}_{4}} $ 与水不能互溶
$ \mathrm{b} $ .碘单质在 $ {\rm {\mathrm{C}\mathrm{C}\mathrm{l}}_{4}} $ 中的溶解度远大于在水中的溶解度
$ {\rm \mathrm{c}.{\mathrm{C}\mathrm{C}\mathrm{l}}_{4}} $ 具有不可燃性
Ⅱ.通过传统的海带提碘工艺后,所得卤水中的碘元素可通过以下流程回收利用:
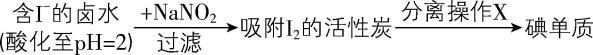
已知: $ {\rm ⅰ.\mathrm{p}\mathrm{H}=2} $ 时, $ {\rm {\mathrm{N}\mathrm{a}\mathrm{N}\mathrm{O}}_{2}} $ 溶液只能将 $ {\rm {\mathrm{I}}^{-}} $ 氧化为 $ {\rm {\mathrm{I}}_{2}} $ ,同时生成 $ {\rm \mathrm{N}\mathrm{O}} $ ;
ⅱ.将湿润的淀粉 $ {\rm -\mathrm{K}\mathrm{I}} $ 试纸伸入盛满氯气的集气瓶中,试纸先变蓝,后褪色。
(3) 写出氧化含 $ {\rm {\mathrm{I}}^{-}} $ 的卤水时发生反应的离子方程式: 。
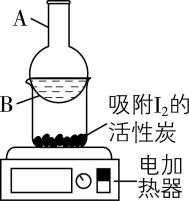
(4) “分离操作 $ {\rm \mathrm{X}} $ ”的装置如图所示,得到 $ {\rm {\mathrm{I}}_{2}} $ 的位置位于该装置中的 处(填序号)。
(5) 已知 $ {\rm {\mathrm{C}\mathrm{l}}_{2}} $ 的氧化性强于 $ {\rm {\mathrm{N}\mathrm{a}\mathrm{N}\mathrm{O}}_{2}} $ ,但该方法中却选择了价格较高的 $ {\rm {\mathrm{N}\mathrm{a}\mathrm{N}\mathrm{O}}_{2}} $ ,原因是 。
答案:(1) $ {\rm {\mathrm{C}\mathrm{l}}_{2}+2{\mathrm{I}}^{-}\xlongequal{}2{\mathrm{C}\mathrm{l}}^{-}+{\mathrm{I}}_{2}} $
(2) $ \mathrm{a}\mathrm{b} $
(3) $ {\rm 2{\mathrm{N}\mathrm{O}}_{2}^{-}+2{\mathrm{I}}^{-}+4{\mathrm{H}}^{+}\xlongequal{}2\mathrm{N}\mathrm{O}↑+{\mathrm{I}}_{2}+2{\mathrm{H}}_{2}\mathrm{O}} $
(4) B
(5) $ {\rm {\mathrm{N}\mathrm{a}\mathrm{N}\mathrm{O}}_{2}} $ 不会把碘元素氧化到更高的价态,便于收集碘单质
解析:(1) 氯气的氧化性强于碘单质,向含 $ {\rm {\mathrm{I}}^{-}} $ 的溶液中通入氯气,发生反应: $ {\rm {\mathrm{C}\mathrm{l}}_{2}+2{\mathrm{I}}^{-}\xlongequal{}2{\mathrm{C}\mathrm{l}}^{-}+{\mathrm{I}}_{2}} $ 。
(2) 选择萃取剂的原则一般为萃取剂不与原溶剂互溶、被萃取物质与萃取剂不能发生反应、被萃取物质在萃取剂中的溶解度远大于在原溶剂中的溶解度,碘单质在四氯化碳中溶解度比在水中大,四氯化碳不与碘单质反应,且四氯化碳不溶于水,因此步骤⑤中可用四氯化碳作萃取剂的理由有 $ \mathrm{a}\mathrm{b} $ 。
(3) 在 $ {\rm \mathrm{p}\mathrm{H}=2} $ 时, $ {\rm {\mathrm{N}\mathrm{a}\mathrm{N}\mathrm{O}}_{2}} $ 溶液只能将 $ {\rm {\mathrm{I}}^{-}} $ 氧化成 $ {\rm {\mathrm{I}}_{2}} $ ,本身被还原成 $ {\rm \mathrm{N}\mathrm{O}} $ ,根据得失电子守恒、原子守恒、电荷守恒,反应的离子方程式为 $ {\rm 2{\mathrm{N}\mathrm{O}}_{2}^{-}+2{\mathrm{I}}^{-}+4{\mathrm{H}}^{+}\xlongequal{}2\mathrm{N}\mathrm{O}↑+{\mathrm{I}}_{2}+2{\mathrm{H}}_{2}\mathrm{O}} $ 。
(4) 碘单质受热易升华,电加热器的作用是加热使碘单质升华,碘蒸气遇冷的烧瓶凝华,得到的碘单质固体附着在 $ {\rm \mathrm{B}} $ 处。
(5) 将湿润的淀粉 $ {\rm -\mathrm{K}\mathrm{I}} $ 试纸伸入盛满氯气的集气瓶中,试纸先变蓝,后褪色,说明过量氯气会将碘单质氧化成更高价态, $ {\rm \mathrm{p}\mathrm{H}=2} $ 时, $ {\rm {\mathrm{N}\mathrm{a}\mathrm{N}\mathrm{O}}_{2}} $ 溶液只能将 $ {\rm {\mathrm{I}}^{-}} $ 氧化成 $ {\rm {\mathrm{I}}_{2}} $ ,因此选择 $ {\rm {\mathrm{N}\mathrm{a}\mathrm{N}\mathrm{O}}_{2}} $ 。