2.下列反应原理中,不符合工业冶炼金属实际情况的是( )
A. $ {\rm 3\mathrm{M}\mathrm{g}\mathrm{O}+2\mathrm{A}\mathrm{l}\xlongequal{高温}3\mathrm{M}\mathrm{g}+{\mathrm{A}\mathrm{l}}_{2}{\mathrm{O}}_{3}} $
B. $ {\rm 3\mathrm{C}\mathrm{O}+{\mathrm{F}\mathrm{e}}_{2}{\mathrm{O}}_{3}\xlongequal{高温}2\mathrm{F}\mathrm{e}+3{\mathrm{C}\mathrm{O}}_{2}} $
C. $ {\rm 2\mathrm{H}\mathrm{g}\mathrm{O}\xlongequal{△}2\mathrm{H}\mathrm{g}+{\mathrm{O}}_{2}↑} $
D. $ {\rm\hspace{-0.5em} \begin{array} {l} \rm 2{\mathrm{A}\mathrm{l}}_{2}{\mathrm{O}}_{3}\left({熔融}\right)\hspace{-0.5em} \begin{array}{c}{电解}\\ \overline{\overline{冰晶石}}\end{array} \hspace{-0.5em}4\mathrm{A}\mathrm{l}+3{\mathrm{O}}_{2}↑\end{array} \hspace{-0.5em} } $
答案:A
解析: $ {\rm \mathrm{M}\mathrm{g}} $ 比 $ {\rm \mathrm{A}\mathrm{l}} $ 活泼,不能用铝热法冶炼,通常用电解熔融的氯化镁的方法冶炼, $ {\rm \mathrm{A}} $ 错误; $ {\rm \mathrm{F}\mathrm{e}} $ 处于金属活动性顺序中的中间位置,通常是用还原剂( $ {\rm \mathrm{C}} $ 、 $ {\rm \mathrm{C}\mathrm{O}} $ 、 $ {\rm {\mathrm{H}}_{2}} $ 、活泼金属等)将 $ {\rm \mathrm{F}\mathrm{e}} $ 从其化合物中还原出来, $ {\rm \mathrm{B}} $ 正确; $ {\rm \mathrm{H}\mathrm{g}} $ 为不活泼金属,可以直接用加热分解的方法将 $ {\rm \mathrm{H}\mathrm{g}} $ 从其化合物中还原出来, $ {\rm \mathrm{C}} $ 正确; $ {\rm \mathrm{A}\mathrm{l}} $ 为活泼金属,通常用电解熔融 $ {\rm {\mathrm{A}\mathrm{l}}_{2}{\mathrm{O}}_{3}} $ 的方法冶炼, $ {\rm \mathrm{D}} $ 正确。
3.冶炼金属有下列方法:①焦炭还原法;②水煤气还原法;③活泼金属置换法;④电解法。冶炼金属的生产实际:古代 $ ——\mathrm{a} $ .火法炼铜, $ \mathrm{b} $ .湿法炼铜;现代 $ ——\mathrm{c} $ .铝热法炼铁, $ \mathrm{d} $ .高炉炼铁。以下生产实际与冶炼方法关系分析错误的是( )
A. $ \mathrm{a}\sim ① $
B. $ \mathrm{b}\sim ② $
C. $ \mathrm{c}\sim ③ $
D. $ \mathrm{d}\sim ① $
答案:B
解析:火法炼铜利用了①焦炭还原法, $ {\rm \mathrm{A}} $ 正确;湿法炼铜是铁置换硫酸铜溶液中的铜,是③活泼金属置换法, $ {\rm \mathrm{B}} $ 错误;铝热法炼铁,是铝还原高熔点的金属氧化物,属于③活泼金属置换法, $ {\rm \mathrm{C}} $ 正确;高炉炼铁利用了①焦炭还原法, $ {\rm \mathrm{D}} $ 正确。
4.在明代宋应星所著的《天工开物》中,有关火法炼锌的工艺记载:“每炉甘石十斤,装载入一泥罐内,……然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,罐中炉甘石熔化成团。冷定毁罐取出。……即倭铅也。……以其似铅而性猛,故名之曰‘倭’云。”炉甘石的主要成分是碳酸锌。下列说法正确的是( )
A. 工业上金属 $ {\rm \mathrm{M}\mathrm{g}} $ 的冶炼方法与锌的冶炼方法一样
B. 古代火法炼锌涉及的主要反应为 $ {\rm {\mathrm{Z}\mathrm{n}\mathrm{C}\mathrm{O}}_{3}+2\mathrm{C}\xlongequal{高温}\mathrm{Z}\mathrm{n}+3\mathrm{C}\mathrm{O}↑} $
C. 煤炭干馏属于物理变化
D. 火法炼锌时需往泥罐中注入大量空气
答案:B
解析:工业上金属 $ {\rm \mathrm{M}\mathrm{g}} $ 通过电解熔融 $ {\rm {\mathrm{M}\mathrm{g}\mathrm{C}\mathrm{l}}_{2}} $ 冶炼,而 $ {\rm \mathrm{Z}\mathrm{n}} $ 通常用热还原法冶炼,方法不同, $ {\rm \mathrm{A}} $ 错误;炉甘石 $ {\rm ({\mathrm{Z}\mathrm{n}\mathrm{C}\mathrm{O}}_{3})} $ 高温下被 $ {\rm \mathrm{C}} $ 还原为 $ {\rm \mathrm{Z}\mathrm{n}} $ 并生成 $ {\rm \mathrm{C}\mathrm{O}} $ ,反应为 $ {\rm {\mathrm{Z}\mathrm{n}\mathrm{C}\mathrm{O}}_{3}+2\mathrm{C}\xlongequal{高温}\mathrm{Z}\mathrm{n}+3\mathrm{C}\mathrm{O}↑} $ , $ {\rm \mathrm{B}} $ 正确;煤炭干馏生成焦炭、煤焦油等新物质,是化学变化, $ {\rm \mathrm{C}} $ 错误;火法炼锌需高温,但反应在还原环境中进行,注入大量空气会消耗还原剂 $ {\rm \mathrm{C}} $ , $ {\rm \mathrm{D}} $ 错误。
5.工业上以某种 $ {\rm {\mathrm{A}\mathrm{l}}_{2}{\mathrm{O}}_{3}} $ 矿石(含 $ {\rm {\mathrm{F}\mathrm{e}}_{2}{\mathrm{O}}_{3}} $ 杂质)为原料冶炼铝的工艺流程如下。下列对该工艺流程的判断正确的是( )
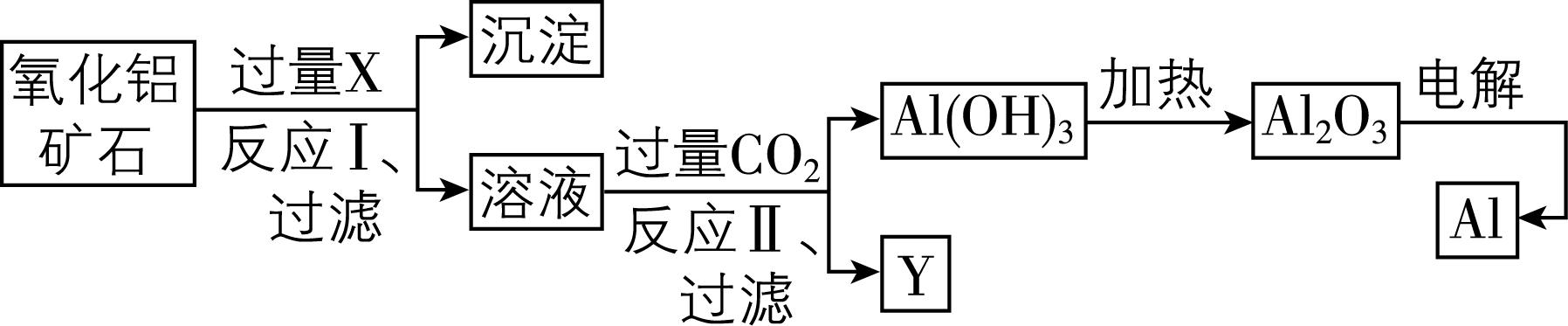
A. 试剂 $ {\rm \mathrm{X}} $ 可以为盐酸,沉淀中含有铁的化合物
B. 反应Ⅱ中, $ {\rm {\mathrm{C}\mathrm{O}}_{2}} $ 也可换成稀硫酸、稀盐酸
C. 反应Ⅱ的离子方程式为 $ {\rm {\mathrm{C}\mathrm{O}}_{2}+ [\mathrm{A}\mathrm{l} (\mathrm{O}\mathrm{H})_{4}{ ]}^{-}\xlongequal{}\mathrm{A}\mathrm{l} (\mathrm{O}\mathrm{H})_{3}↓+{\mathrm{H}\mathrm{C}\mathrm{O}}_{3}^{-}} $
D. 工业上还可采用 $ {\rm \mathrm{F}\mathrm{e}} $ 还原 $ {\rm {\mathrm{A}\mathrm{l}}_{2}{\mathrm{O}}_{3}} $ 的方法制 $ {\rm \mathrm{A}\mathrm{l}} $ ,成本更低
答案:C
解析:若 $ {\rm \mathrm{X}} $ 是盐酸,则 $ {\rm {\mathrm{A}\mathrm{l}}_{2}{\mathrm{O}}_{3}} $ 、 $ {\rm {\mathrm{F}\mathrm{e}}_{2}{\mathrm{O}}_{3}} $ 都会溶解,形成可溶的 $ {\rm {\mathrm{A}\mathrm{l}\mathrm{C}\mathrm{l}}_{3}} $ 、 $ {\rm {\mathrm{F}\mathrm{e}\mathrm{C}\mathrm{l}}_{3}} $ , $ {\rm \mathrm{A}} $ 错误;在反应Ⅱ中,若将 $ {\rm {\mathrm{C}\mathrm{O}}_{2}} $ 换成稀硫酸、稀盐酸, $ {\rm \mathrm{A}\mathrm{l}(\mathrm{O}\mathrm{H})_{3}} $ 是两性氢氧化物,会被过量强酸溶解,不能得到 $ {\rm \mathrm{A}\mathrm{l}(\mathrm{O}\mathrm{H})_{3}} $ 沉淀, $ {\rm \mathrm{B}} $ 错误;过量 $ {\rm {\mathrm{C}\mathrm{O}}_{2}} $ 与 $ {\rm \mathrm{N}\mathrm{a} [\mathrm{A}\mathrm{l} (\mathrm{O}\mathrm{H})_{4} ]} $ 反应产生 $ {\rm {\mathrm{N}\mathrm{a}\mathrm{H}\mathrm{C}\mathrm{O}}_{3}} $ 、 $ {\rm \mathrm{A}\mathrm{l}(\mathrm{O}\mathrm{H})_{3}} $ 沉淀,反应的离子方程式为 $ {\rm {\mathrm{C}\mathrm{O}}_{2}+ [\mathrm{A}\mathrm{l} (\mathrm{O}\mathrm{H})_{4}{ ]}^{-}\xlongequal{}\mathrm{A}\mathrm{l} (\mathrm{O}\mathrm{H})_{3}↓+{\mathrm{H}\mathrm{C}\mathrm{O}}_{3}^{-}} $ , $ {\rm \mathrm{C}} $ 正确;由于金属活动性: $ {\rm \mathrm{A}\mathrm{l} > \mathrm{F}\mathrm{e}} $ ,因此 $ {\rm \mathrm{F}\mathrm{e}} $ 不能置换出 $ {\rm \mathrm{A}\mathrm{l}} $ ,所以在工业上不能采用 $ {\rm \mathrm{F}\mathrm{e}} $ 还原 $ {\rm {\mathrm{A}\mathrm{l}}_{2}{\mathrm{O}}_{3}} $ 的方法制 $ {\rm \mathrm{A}\mathrm{l}} $ ,应采用电解熔融氧化铝的方法冶炼铝, $ {\rm \mathrm{D}} $ 错误。
6.实验室中,采用废易拉罐(主要成分为 $ {\rm \mathrm{A}\mathrm{l}} $ ,含有少量的 $ {\rm \mathrm{F}\mathrm{e}} $ 、 $ {\rm \mathrm{M}\mathrm{g}} $ 杂质)制备明矾 $ {\rm [\mathrm{K}\mathrm{A}\mathrm{l} ({\mathrm{S}\mathrm{O}}_{4})_{2}\cdot 12{\mathrm{H}}_{2}\mathrm{O} ]} $ 的过程如下所示。
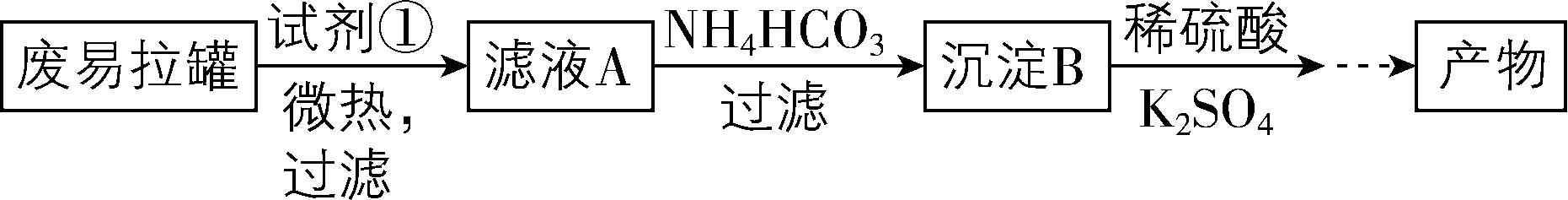
请回答下列问题:
(1) 为尽量少引入杂质,试剂①应选用 (填序号)。
A. 稀盐酸B. 稀硫酸C. 氨水D. $ {\rm \mathrm{N}\mathrm{a}\mathrm{O}\mathrm{H}} $ 溶液
(2) 废易拉罐溶解过程中主要反应的离子方程式为 。
(3) 沉淀B的化学式为 。
(4) 由沉淀B生成 $ {\rm \mathrm{K}\mathrm{A}\mathrm{l}({\mathrm{S}\mathrm{O}}_{4})_{2}} $ 的化学方程式为 。
(5) 向 $ {\rm 30\mathrm{m}\mathrm{L}1\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}} $ 的 $ {\rm \mathrm{K}\mathrm{A}\mathrm{l}({\mathrm{S}\mathrm{O}}_{4})_{2}} $ 溶液中逐渐加入浓度为 $ {\rm 4\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}} $ 的 $ {\rm \mathrm{N}\mathrm{a}\mathrm{O}\mathrm{H}} $ 溶液,若产生 $ 0.78\mathrm{g} $ 白色沉淀,则加入的 $ {\rm \mathrm{N}\mathrm{a}\mathrm{O}\mathrm{H}} $ 溶液的体积为 。
答案:(1) D
(2) $ {\rm 2\mathrm{A}\mathrm{l}+2{\mathrm{O}\mathrm{H}}^{-}+6{\mathrm{H}}_{2}\mathrm{O}\xlongequal{}2 [\mathrm{A}\mathrm{l} (\mathrm{O}\mathrm{H})_{4}{ ]}^{-}+3{\mathrm{H}}_{2}↑} $
(3) $ {\rm \mathrm{A}\mathrm{l}(\mathrm{O}\mathrm{H})_{3}} $
(4) $ {\rm 2\mathrm{A}\mathrm{l}(\mathrm{O}\mathrm{H})_{3}+3{\mathrm{H}}_{2}{\mathrm{S}\mathrm{O}}_{4}+{\mathrm{K}}_{2}{\mathrm{S}\mathrm{O}}_{4}\xlongequal{}2\mathrm{K}\mathrm{A}\mathrm{l}({\mathrm{S}\mathrm{O}}_{4})_{2}+6{\mathrm{H}}_{2}\mathrm{O}} $
(5) $ {\rm 7.5\mathrm{m}\mathrm{L}} $ 或 $ {\rm 27.5\mathrm{m}\mathrm{L}} $
解析:6.废易拉罐的主要成分为 $ {\rm \mathrm{A}\mathrm{l}} $ ,含有少量的 $ {\rm \mathrm{F}\mathrm{e}} $ 、 $ {\rm \mathrm{M}\mathrm{g}} $ 杂质, $ {\rm \mathrm{N}\mathrm{a}\mathrm{O}\mathrm{H}} $ 溶液能溶解 $ {\rm \mathrm{A}\mathrm{l}} $ 并生成 $ {\rm \mathrm{N}\mathrm{a} [\mathrm{A}\mathrm{l} (\mathrm{O}\mathrm{H})_{4} ]} $ ,但不溶解其他金属杂质,过滤,向滤液中加入 $ {\rm {\mathrm{N}\mathrm{H}}_{4}{\mathrm{H}\mathrm{C}\mathrm{O}}_{3}} $ , $ {\rm {\mathrm{N}\mathrm{H}}_{4}{\mathrm{H}\mathrm{C}\mathrm{O}}_{3}} $ 与 $ {\rm \mathrm{N}\mathrm{a} [\mathrm{A}\mathrm{l} (\mathrm{O}\mathrm{H})_{4} ]} $ 反应生成 $ {\rm \mathrm{A}\mathrm{l}(\mathrm{O}\mathrm{H})_{3}} $ 沉淀,向 $ {\rm \mathrm{A}\mathrm{l}(\mathrm{O}\mathrm{H})_{3}} $ 中加入稀硫酸、 $ {\rm {\mathrm{K}}_{2}{\mathrm{S}\mathrm{O}}_{4}} $ ,反应生成 $ {\rm \mathrm{K}\mathrm{A}\mathrm{l}({\mathrm{S}\mathrm{O}}_{4})_{2}} $ 和 $ {\rm {\mathrm{H}}_{2}\mathrm{O}} $ 。
(1) 废易拉罐的主要成分为 $ {\rm \mathrm{A}\mathrm{l}} $ ,但其中含有少量的 $ {\rm \mathrm{F}\mathrm{e}} $ 、 $ {\rm \mathrm{M}\mathrm{g}} $ ,为尽量少引入杂质,只溶解 $ {\rm \mathrm{A}\mathrm{l}} $ ,不溶解 $ {\rm \mathrm{F}\mathrm{e}} $ 、 $ {\rm \mathrm{M}\mathrm{g}} $ ,故不能用酸溶解; $ {\rm \mathrm{A}\mathrm{l}} $ 不与氨水反应,不能用氨水溶解,只能用 $ {\rm \mathrm{N}\mathrm{a}\mathrm{O}\mathrm{H}} $ 溶液溶解。
(2) 易拉罐溶解过程中 $ {\rm \mathrm{A}\mathrm{l}} $ 和 $ {\rm \mathrm{N}\mathrm{a}\mathrm{O}\mathrm{H}} $ 溶液反应生成四羟基合铝酸钠和氢气,主要反应的离子方程式为 $ {\rm 2\mathrm{A}\mathrm{l}+2{\mathrm{O}\mathrm{H}}^{-}+6{\mathrm{H}}_{2}\mathrm{O}\xlongequal{}2 [\mathrm{A}\mathrm{l} (\mathrm{O}\mathrm{H})_{4}{ ]}^{-}+3{\mathrm{H}}_{2}↑} $ 。
(3) 滤液 $ {\rm \mathrm{A}} $ 中的溶质是 $ {\rm \mathrm{N}\mathrm{a} [\mathrm{A}\mathrm{l} (\mathrm{O}\mathrm{H})_{4} ]} $ , $ {\rm \mathrm{N}\mathrm{a} [\mathrm{A}\mathrm{l} (\mathrm{O}\mathrm{H})_{4} ]} $ 和 $ {\rm {\mathrm{N}\mathrm{H}}_{4}{\mathrm{H}\mathrm{C}\mathrm{O}}_{3}} $ 反应生成氢氧化铝沉淀,因此沉淀 $ {\rm \mathrm{B}} $ 的化学式为 $ {\rm \mathrm{A}\mathrm{l}(\mathrm{O}\mathrm{H})_{3}} $ 。
(4) 由 $ {\rm \mathrm{A}\mathrm{l}(\mathrm{O}\mathrm{H})_{3}} $ 生成 $ {\rm \mathrm{K}\mathrm{A}\mathrm{l}({\mathrm{S}\mathrm{O}}_{4})_{2}} $ 的化学方程式为 $ {\rm 2\mathrm{A}\mathrm{l}(\mathrm{O}\mathrm{H})_{3}+3{\mathrm{H}}_{2}{\mathrm{S}\mathrm{O}}_{4}+{\mathrm{K}}_{2}{\mathrm{S}\mathrm{O}}_{4}\xlongequal{}2\mathrm{K}\mathrm{A}\mathrm{l}({\mathrm{S}\mathrm{O}}_{4})_{2}+6{\mathrm{H}}_{2}\mathrm{O}} $ 。
(5) $ {\rm 30\mathrm{m}\mathrm{L}1\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}} $ 的 $ {\rm \mathrm{K}\mathrm{A}\mathrm{l}({\mathrm{S}\mathrm{O}}_{4})_{2}} $ 溶液中 $ {\rm {\mathrm{A}\mathrm{l}}^{3+}} $ 的物质的量为 $ 0.03\mathrm{m}\mathrm{o}\mathrm{l} $ ,向溶液中逐渐加入浓度为 $ {\rm 4\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}} $ 的 $ {\rm \mathrm{N}\mathrm{a}\mathrm{O}\mathrm{H}} $ 溶液,产生 $ {\rm 0.78\mathrm{g}\mathrm{A}\mathrm{l}(\mathrm{O}\mathrm{H})_{3}} $ 白色沉淀,即沉淀的物质的量为 $ 0.01\mathrm{m}\mathrm{o}\mathrm{l} $ 。分两种情况讨论,第一种情况:向含 $ {\rm 0.03\mathrm{m}\mathrm{o}\mathrm{l}{\mathrm{A}\mathrm{l}}^{3+}} $ 的溶液中逐滴加入 $ {\rm \mathrm{N}\mathrm{a}\mathrm{O}\mathrm{H}} $ 至开始产生 $ {\rm 0.01\mathrm{m}\mathrm{o}\mathrm{l}\mathrm{A}\mathrm{l}(\mathrm{O}\mathrm{H})_{3}} $ 沉淀,根据 $ {\rm {\mathrm{A}\mathrm{l}}^{3+}+3{\mathrm{O}\mathrm{H}}^{-}\xlongequal{}\mathrm{A}\mathrm{l}(\mathrm{O}\mathrm{H})_{3}↓} $ ,可知生成 $ {\rm 0.01\mathrm{m}\mathrm{o}\mathrm{l}\mathrm{A}\mathrm{l}(\mathrm{O}\mathrm{H})_{3}} $ 沉淀消耗 $ {\rm 0.03\mathrm{m}\mathrm{o}\mathrm{l}\mathrm{N}\mathrm{a}\mathrm{O}\mathrm{H}} $ , $ {\rm V(\mathrm{N}\mathrm{a}\mathrm{O}\mathrm{H}溶液)=\dfrac{n}{c}=\dfrac{0.03\mathrm{m}\mathrm{o}\mathrm{l}}{4\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}}=0.0075\mathrm{L}} $ ,即 $ {\rm 7.5\mathrm{m}\mathrm{L}} $ ;第二种情况:先加 $ {\rm \mathrm{N}\mathrm{a}\mathrm{O}\mathrm{H}} $ 溶液至沉淀完全,再继续加入 $ {\rm \mathrm{N}\mathrm{a}\mathrm{O}\mathrm{H}} $ 溶液至沉淀溶解到还剩 $ 0.01\mathrm{m}\mathrm{o}\mathrm{l} $ ,根据 $ {\rm {\mathrm{A}\mathrm{l}}^{3+}+3{\mathrm{O}\mathrm{H}}^{-}\xlongequal{}\mathrm{A}\mathrm{l}(\mathrm{O}\mathrm{H})_{3}↓} $ ,当 $ {\rm {\mathrm{A}\mathrm{l}}^{3+}} $ 沉淀完全时消耗 $ {\rm \mathrm{N}\mathrm{a}\mathrm{O}\mathrm{H}} $ 物质的量为 $ 0.09\mathrm{m}\mathrm{o}\mathrm{l} $ ,再根据 $ {\rm \mathrm{A}\mathrm{l} (\mathrm{O}\mathrm{H})_{3}+{\mathrm{O}\mathrm{H}}^{-}\xlongequal{} [\mathrm{A}\mathrm{l} (\mathrm{O}\mathrm{H})_{4}{ ]}^{-}} $ ,溶解 $ {\rm 0.02\mathrm{m}\mathrm{o}\mathrm{l}\mathrm{A}\mathrm{l}(\mathrm{O}\mathrm{H})_{3}} $ 消耗 $ {\rm \mathrm{N}\mathrm{a}\mathrm{O}\mathrm{H}} $ 的物质的量为 $ 0.02\mathrm{m}\mathrm{o}\mathrm{l} $ ,共消耗 $ {\rm 0.11\mathrm{m}\mathrm{o}\mathrm{l}\mathrm{N}\mathrm{a}\mathrm{O}\mathrm{H}} $ , $ {\rm V(\mathrm{N}\mathrm{a}\mathrm{O}\mathrm{H}溶液)=\dfrac{n}{c}=\dfrac{0.11\mathrm{m}\mathrm{o}\mathrm{l}}{4\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}}=0.0275\mathrm{L}} $ 即 $ {\rm 27.5\mathrm{m}\mathrm{L}} $ 。

