第六章高考强化
一、刷真题
1.酸性锌锰干电池的构造示意图如下。关于该电池及其工作原理,下列说法正确的是( )
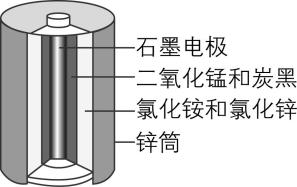
A. 石墨作电池的负极材料
B. 电池工作时, $ {\rm {\mathrm{N}\mathrm{H}}_{4}^{+}} $ 向负极方向移动
C. $ {\rm {\mathrm{M}\mathrm{n}\mathrm{O}}_{2}} $ 发生氧化反应
D. 锌筒发生的电极反应为 $ {\rm \mathrm{Z}\mathrm{n}-2{\mathrm{e}}^{-}\xlongequal{}{\mathrm{Z}\mathrm{n}}^{2+}} $
答案:D
解析:酸性锌锰干电池中锌筒为负极,发生氧化反应,电极反应式为 $ {\rm \mathrm{Z}\mathrm{n}-2{\mathrm{e}}^{-}\xlongequal{}{\mathrm{Z}\mathrm{n}}^{2+}} $ ,石墨电极为正极, $ {\rm {\mathrm{M}\mathrm{n}\mathrm{O}}_{2}} $ 在正极发生还原反应, $ {\rm \mathrm{A}} $ 、 $ {\rm \mathrm{C}} $ 错误, $ {\rm \mathrm{D}} $ 正确;原电池工作时,阳离子向正极(即石墨电极)方向移动, $ {\rm \mathrm{B}} $ 错误。
2.某小组进行实验,向 $ {\rm 10\mathrm{m}\mathrm{L}} $ 蒸馏水中加入 $ {\rm 0.4\mathrm{g}{\mathrm{I}}_{2}} $ ,充分振荡,溶液呈浅棕色;再加入 $ 0.2\mathrm{g} $ 锌粒,溶液颜色加深;最终紫黑色晶体消失,溶液褪色。已知 $ {\rm {\mathrm{I}}_{3}^{-}(\mathrm{a}\mathrm{q})} $ 为棕色,下列关于颜色变化的解释错误的是( )
选项 | 颜色变化 | 解释 |
A | 溶液呈浅棕色 | $ {\rm {\mathrm{I}}_{2}} $ 在水中溶解度较小 |
B | 溶液颜色加深 | 发生了反应 $ {\rm {\mathrm{I}}_{2}+{\mathrm{I}}^{-}⇌{\mathrm{I}}_{3}^{-}} $ |
C | 紫黑色晶体消失 | $ {\rm {\mathrm{I}}_{2}(\mathrm{a}\mathrm{q})} $ 的消耗使溶解平衡 $ {\rm {\mathrm{I}}_{2}(\mathrm{s})⇌{\mathrm{I}}_{2}(\mathrm{a}\mathrm{q})} $ 右移 |
D | 溶液褪色 | $ {\rm \mathrm{Z}\mathrm{n}} $ 与有色物质发生了置换反应 |
解析: $ {\rm {\mathrm{I}}_{2}} $ 在水中的溶解度较小, $ {\rm {\mathrm{I}}_{2}} $ 溶于水后,水溶液呈浅棕色, $ {\rm \mathrm{A}} $ 正确;加入的锌粒与 $ {\rm {\mathrm{I}}_{2}} $ 反应生成 $ {\rm {\mathrm{I}}^{-}} $ ,溶液中 $ {\rm c({\mathrm{I}}^{-})} $ 增大,促使 $ {\rm {\mathrm{I}}_{2}+{\mathrm{I}}^{-}⇌{\mathrm{I}}_{3}^{-}} $ 平衡正向移动,生成了棕色的 $ {\rm {\mathrm{I}}_{3}^{-}} $ ,导致溶液颜色加深, $ {\rm \mathrm{B}} $ 正确; $ {\rm \mathrm{Z}\mathrm{n}} $ 消耗溶液中的 $ {\rm {\mathrm{I}}_{2}} $ , $ {\rm c[{\mathrm{I}}_{2}(\mathrm{a}\mathrm{q})]} $ 减小,促使溶解平衡 $ {\rm {\mathrm{I}}_{2}(\mathrm{s})⇌{\mathrm{I}}_{2}(\mathrm{a}\mathrm{q})} $ 右移,紫黑色晶体逐渐消失, $ {\rm \mathrm{C}} $ 正确;锌粒与 $ {\rm {\mathrm{I}}_{2}} $ 发生化合反应 $ {\rm \mathrm{Z}\mathrm{n}+{\mathrm{I}}_{2}\xlongequal{}{\mathrm{Z}\mathrm{n}\mathrm{I}}_{2}} $ , $ {\rm \mathrm{D}} $ 错误。
3.以稀 $ {\rm {\mathrm{H}}_{2}{\mathrm{S}\mathrm{O}}_{4}} $ 为电解质溶液的光解水装置如图所示,总反应为 $ {\rm\hspace{-0.5em} \begin{array} {l} \rm 2{\mathrm{H}}_{2}\mathrm{O}\hspace{-0.5em} \begin{array}{c}光\\ \overline{\overline{催化剂}}\end{array} \hspace{-0.5em}2{\mathrm{H}}_{2}↑+{\mathrm{O}}_{2}↑\end{array} \hspace{-0.5em} } $ 。下列说法正确的是( )
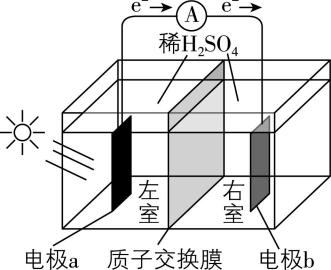
A. 电极 $ \mathrm{a} $ 上发生氧化反应生成 $ {\rm {\mathrm{O}}_{2}} $
B. $ {\rm {\mathrm{H}}^{+}} $ 通过质子交换膜从右室移向左室
C. 光解前后, $ {\rm {\mathrm{H}}_{2}{\mathrm{S}\mathrm{O}}_{4}} $ 溶液的 $ {\rm \mathrm{p}\mathrm{H}} $ 不变
D. 外电路每通过 $ 0.01\mathrm{m}\mathrm{o}\mathrm{l} $ 电子,电极 $ \mathrm{b} $ 上产生 $ {\rm 0.01\mathrm{m}\mathrm{o}\mathrm{l}{\mathrm{H}}_{2}} $
答案:A
解析:电极 $ \mathrm{a} $ 上发生氧化反应生成 $ {\rm {\mathrm{O}}_{2}} $ , $ {\rm \mathrm{A}} $ 正确;电极 $ \mathrm{a} $ 上生成 $ {\rm {\mathrm{H}}^{+}} $ ,电极 $ \mathrm{b} $ 上消耗 $ {\rm {\mathrm{H}}^{+}} $ , $ {\rm {\mathrm{H}}^{+}} $ 通过质子交换膜从左室移向右室, $ {\rm \mathrm{B}} $ 错误;在探究溶液浓度变化时,不仅要关注溶质的变化,也要关注溶剂的变化,在光解过程中, $ {\rm {\mathrm{H}}_{2}{\mathrm{S}\mathrm{O}}_{4}} $ 溶液中 $ {\rm {\mathrm{H}}_{2}\mathrm{O}} $ 减少, $ {\rm {\mathrm{H}}_{2}{\mathrm{S}\mathrm{O}}_{4}} $ 溶液浓度增大, $ {\rm \mathrm{p}\mathrm{H}} $ 减小, $ {\rm \mathrm{C}} $ 错误;生成 $ {\rm 1\mathrm{m}\mathrm{o}\mathrm{l}{\mathrm{H}}_{2}} $ ,转移 $ 2\mathrm{m}\mathrm{o}\mathrm{l} $ 电子,外电路通过 $ 0.01\mathrm{m}\mathrm{o}\mathrm{l} $ 电子时,电极 $ \mathrm{b} $ 上生成 $ {\rm 0.005\mathrm{m}\mathrm{o}\mathrm{l}{\mathrm{H}}_{2}} $ , $ {\rm \mathrm{D}} $ 错误。
4.恒温恒容的密闭容器中,在某催化剂表面上发生氨的分解反应: $ {\rm 2{\mathrm{N}\mathrm{H}}_{3}(\mathrm{g})\stackrel{催化剂}{⇌}{\mathrm{N}}_{2}(\mathrm{g})+3{\mathrm{H}}_{2}(\mathrm{g})} $ ,测得不同起始浓度和催化剂表面积下氨浓度随时间的变化,如下表所示,下列说法不正确的是( )
编号 | 时间/ $ \min $ $ {\rm c({\mathrm{N}\mathrm{H}}_{3})/({10}^{-3}\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-}1)} $ 表面积/ $ {\mathrm{c}\mathrm{m}}^{2} $ | 0 | 20 | 40 | 60 | 80 |
① | $ a $ | 2.40 | 2.00 | 1.60 | 1.20 | 0.80 |
② | $ a $ | 1.20 | 0.80 | 0.40 | $ x $ | |
③ | $ 2a $ | 2.40 | 1.60 | 0.80 | 0.40 | 0.40 |
A. 实验①, $ 0\sim 20 \min $ , $ {\rm v({\mathrm{N}}_{2})=1.00×{10}^{-5}\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}\cdot { \min }^{-1}} $
B. 实验②, $ 60 \min $ 时处于平衡状态, $ x\ne 0.40 $
C. 相同条件下,增加氨气的浓度,反应速率增大
D. 相同条件下,增加催化剂的表面积,反应速率增大
答案:C
解析:实验①中, $ 0\sim 20 \min $ 内 $ {\rm v({\mathrm{N}\mathrm{H}}_{3})=\dfrac{(2.40-2.00)×{10}^{-3}\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}}{20 \min }=2.00×{10}^{-5}\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}\cdot { \min }^{-1}} $ ,反应速率之比等于化学计量数之比,则 $ {\rm v({\mathrm{N}}_{2})=1.00×{10}^{-5}\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}\cdot { \min }^{-1}} $ , $ {\rm \mathrm{A}} $ 正确;对比实验①、②,实验 $ {\rm ②{\mathrm{N}\mathrm{H}}_{3}} $ 初始浓度减半,实验①中平衡相当于是在实验②中平衡体系各物质浓度的2倍基础上逆向移动得到的,则实验②平衡时 $ {\rm c({\mathrm{N}\mathrm{H}}_{3}) < 0.40×{10}^{-3}\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}} $ ,故 $ x < 0.40 $ , $ {\rm \mathrm{B}} $ 正确;由实验①和②知,前 $ 20 \min $ 内, $ {\rm v({\mathrm{N}\mathrm{H}}_{3})=\dfrac{0.40×{10}^{-3}\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}}{20 \min }=2.00×{10}^{-5}\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}\cdot { \min }^{-1}} $ ,增大氨气浓度,反应速率不变, $ {\rm \mathrm{C}} $ 错误;对比实验①和实验③知,增加催化剂的表面积,反应速率增大, $ {\rm \mathrm{D}} $ 正确。
5.室温下,为探究纳米铁去除水样中 $ {\rm {\mathrm{S}\mathrm{e}\mathrm{O}}_{4}^{2-}} $ 的影响因素,测得不同条件下 $ {\rm {\mathrm{S}\mathrm{e}\mathrm{O}}_{4}^{2-}} $ 浓度随时间变化关系如图。
实验序号 | 水样体积/ $ {\rm \mathrm{m}\mathrm{L}} $ | 纳米铁质量/ $ \mathrm{m}\mathrm{g} $ | 水样初始 $ {\rm \mathrm{p}\mathrm{H}} $ |
① | 50 | 8 | 6 |
② | 50 | 2 | 6 |
③ | 50 | 2 | 8 |
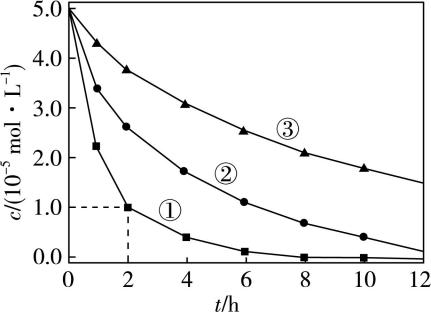
下列说法正确的是( )
A. 实验①中, $ 0\sim 2 $ 小时内平均反应速率 $ {\rm v({\mathrm{S}\mathrm{e}\mathrm{O}}_{4}^{2-})=2.0\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}\cdot {\mathrm{h}}^{-1}} $
B. 实验③中,反应的离子方程式为 $ {\rm 2\mathrm{F}\mathrm{e}+{\mathrm{S}\mathrm{e}\mathrm{O}}_{4}^{2-}+8{\mathrm{H}}^{+}\xlongequal{}2{\mathrm{F}\mathrm{e}}^{3+}+\mathrm{S}\mathrm{e}+4{\mathrm{H}}_{2}\mathrm{O}} $
C. 其他条件相同时,适当增加纳米铁质量可加快反应速率
D. 其他条件相同时,水样初始 $ {\rm \mathrm{p}\mathrm{H}} $ 越小, $ {\rm {\mathrm{S}\mathrm{e}\mathrm{O}}_{4}^{2-}} $ 的去除效果越好
答案:C
解析:由题图可知,实验①中, $ 0\sim 2 $ 小时内 $ {\rm {\mathrm{S}\mathrm{e}\mathrm{O}}_{4}^{2-}} $ 的浓度由 $ {\rm 5.0×{10}^{-5}\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}} $ 减小到 $ {\rm 1.0×{10}^{-5}\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}} $ ,所以平均反应速率 $ {\rm v({\mathrm{S}\mathrm{e}\mathrm{O}}_{4}^{2-})=\dfrac{5.0×{10}^{-5}\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}-1.0×{10}^{-5}\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}}{2\mathrm{h}}=2.0×{10}^{-5}\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}\cdot {\mathrm{h}}^{-1}} $ , $ {\rm \mathrm{A}} $ 错误;实验③水样初始 $ {\rm \mathrm{p}\mathrm{H}} $ 为8,呈碱性,反应的离子方程式中,反应物不应有 $ {\rm {\mathrm{H}}^{+}} $ , $ {\rm \mathrm{B}} $ 错误;对比实验①和实验②可知,当其他条件相同时,适当增加纳米铁质量可加快反应速率, $ {\rm \mathrm{C}} $ 正确; $ {\rm \mathrm{p}\mathrm{H}} $ 过低、酸性太强会消耗纳米铁,从而减弱 $ {\rm {\mathrm{S}\mathrm{e}\mathrm{O}}_{4}^{2-}} $ 的去除效果, $ {\rm \mathrm{D}} $ 错误。
6.反应 $ {\rm \mathrm{X}\xlongequal{}2\mathrm{Z}} $ 经历两步: $ {\rm ①\mathrm{X}\to \mathrm{Y}} $ ; $ {\rm ②\mathrm{Y}\to 2\mathrm{Z}} $ 。反应体系中 $ {\rm \mathrm{X}} $ 、 $ {\rm \mathrm{Y}} $ 、 $ {\rm \mathrm{Z}} $ 的浓度 $ c $ 随时间 $ t $ 的变化曲线如图所示。下列说法不正确的是( )
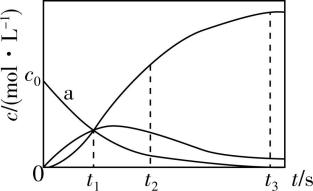
A. $ \mathrm{a} $ 为 $ {\rm c(\mathrm{X})} $ 随 $ t $ 的变化曲线
B. $ {t}_{1} $ 时, $ {\rm c(\mathrm{X})=c(\mathrm{Y})=c(\mathrm{Z})} $
C. $ {t}_{2} $ 时, $ {\rm \mathrm{Y}} $ 的消耗速率大于生成速率
D. $ {t}_{3} $ 后, $ {\rm c(\mathrm{Z})=2{c}_{0}-c(\mathrm{Y})} $
答案:D
解析:由于 $ {\rm \mathrm{X}\xlongequal{}2\mathrm{Z}} $ 反应分 $ {\rm ①\mathrm{X}\to \mathrm{Y}} $ 和 $ {\rm ②\mathrm{Y}\to 2\mathrm{Z}} $ 两步进行,随着不断反应, $ {\rm \mathrm{X}} $ 的浓度逐渐减小, $ {\rm \mathrm{Y}} $ 的浓度先增加后减小, $ {\rm \mathrm{Z}} $ 的浓度逐渐增大,可知 $ \mathrm{a} $ 表示 $ {\rm c(\mathrm{X})} $ 随 $ t $ 的变化曲线, $ {\rm \mathrm{A}} $ 项正确; $ {t}_{1} $ 时,图像中三条曲线相交在同一点,即三者的物质的量浓度相等, $ {\rm \mathrm{B}} $ 项正确; $ {t}_{2} $ 时 $ {\rm \mathrm{Y}} $ 的物质的量浓度在减小,说明 $ {\rm \mathrm{Y}} $ 的消耗速率大于生成速率, $ {\rm \mathrm{C}} $ 项正确;从图像中看出 $ {t}_{3} $ 后, $ {\rm \mathrm{X}} $ 的浓度为0,若全生成 $ {\rm \mathrm{Z}} $ ,则 $ {\rm c(\mathrm{Z})=2{c}_{0}} $ ,体系中存在一定量 $ {\rm \mathrm{Y}} $ ,根据②反应可知,体系中 $ {\rm c(\mathrm{Z})=2{c}_{0}-2c(\mathrm{Y})} $ , $ {\rm \mathrm{D}} $ 项错误。
7.一种基于 $ {\rm {\mathrm{C}\mathrm{u}}_{2}\mathrm{O}} $ 的储氯电池装置如图,放电过程中 $ \mathrm{a} $ 、 $ \mathrm{b} $ 极均增重。若将 $ \mathrm{b} $ 极换成 $ {\rm \mathrm{A}\mathrm{g}/\mathrm{A}\mathrm{g}\mathrm{C}\mathrm{l}} $ 电极, $ \mathrm{b} $ 极仍增重。关于图中装置所示电池,下列说法错误的是( )
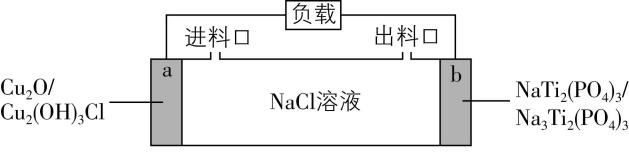
A. 放电时 $ {\rm {\mathrm{N}\mathrm{a}}^{+}} $ 向 $ \mathrm{b} $ 极迁移
B. 该电池可用于海水脱盐
C. $ \mathrm{a} $ 极反应: $ {\rm {\mathrm{C}\mathrm{u}}_{2}\mathrm{O}+2{\mathrm{H}}_{2}\mathrm{O}+{\mathrm{C}\mathrm{l}}^{-}-2{\mathrm{e}}^{-}\xlongequal{}{\mathrm{C}\mathrm{u}}_{2}(\mathrm{O}\mathrm{H})_{3}\mathrm{C}\mathrm{l}+{\mathrm{H}}^{+}} $
D. 若以 $ {\rm \mathrm{A}\mathrm{g}/\mathrm{A}\mathrm{g}\mathrm{C}\mathrm{l}} $ 电极代替 $ \mathrm{a} $ 极,电池将失去储氯能力
答案:D
解析:放电时阳离子 $ {\rm ({\mathrm{N}\mathrm{a}}^{+})} $ 向正极 $ (\mathrm{b} $ 极 $ ) $ 迁移, $ {\rm \mathrm{A}} $ 正确;该电池负极消耗 $ {\rm {\mathrm{C}\mathrm{l}}^{-}} $ 、正极消耗 $ {\rm {\mathrm{N}\mathrm{a}}^{+}} $ ,所以可用于海水脱盐, $ {\rm \mathrm{B}} $ 正确;根据思路导引可知, $ {\rm \mathrm{C}} $ 正确;由原电池电极反应可知还原性: $ {\rm {\mathrm{C}\mathrm{u}}_{2}\mathrm{O} > {\mathrm{N}\mathrm{a}}_{3}{\mathrm{T}\mathrm{i}}_{2}({\mathrm{P}\mathrm{O}}_{4})_{3}} $ ,而将 $ \mathrm{b} $ 极换为 $ {\rm \mathrm{A}\mathrm{g}/\mathrm{A}\mathrm{g}\mathrm{C}\mathrm{l}} $ 电极后 $ \mathrm{b} $ 极仍增重,则此时 $ \mathrm{b} $ 极电极反应式为 $ {\rm \mathrm{A}\mathrm{g}-{\mathrm{e}}^{-}+{\mathrm{C}\mathrm{l}}^{-}\xlongequal{}\mathrm{A}\mathrm{g}\mathrm{C}\mathrm{l}} $ ,所以该电极作为负极,则还原性: $ {\rm \mathrm{A}\mathrm{g} > {\mathrm{C}\mathrm{u}}_{2}\mathrm{O}} $ ,综合可知还原性: $ {\rm \mathrm{A}\mathrm{g} > {\mathrm{C}\mathrm{u}}_{2}\mathrm{O} > {\mathrm{N}\mathrm{a}}_{3}{\mathrm{T}\mathrm{i}}_{2}({\mathrm{P}\mathrm{O}}_{4})_{3}} $ ,若以 $ {\rm \mathrm{A}\mathrm{g}/\mathrm{A}\mathrm{g}\mathrm{C}\mathrm{l}} $ 电极代替 $ \mathrm{a} $ 极,则 $ \mathrm{a} $ 极电极反应式为 $ {\rm \mathrm{A}\mathrm{g}-{\mathrm{e}}^{-}+{\mathrm{C}\mathrm{l}}^{-}\xlongequal{}\mathrm{A}\mathrm{g}\mathrm{C}\mathrm{l}} $ 、 $ \mathrm{b} $ 极电极反应式为 $ {\rm {\mathrm{N}\mathrm{a}\mathrm{T}\mathrm{i}}_{2}({\mathrm{P}\mathrm{O}}_{4})_{3}+2{\mathrm{e}}^{-}+2{\mathrm{N}\mathrm{a}}^{+}\xlongequal{}{\mathrm{N}\mathrm{a}}_{3}{\mathrm{T}\mathrm{i}}_{2}({\mathrm{P}\mathrm{O}}_{4})_{3}} $ ,电池不会失去储氯能力, $ {\rm \mathrm{D}} $ 错误。
8.用如图所示电化学装置进行如下实验。
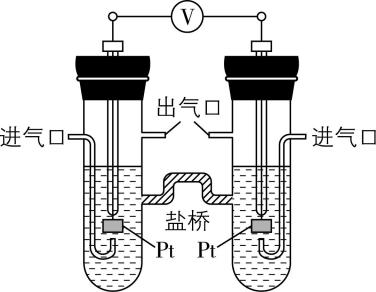
(1) 用 $ {\rm {\mathrm{H}}_{2}} $ 实验:在左侧通入 $ {\rm {\mathrm{H}}_{2}} $ ,产物为 $ {\rm {\mathrm{H}}_{2}\mathrm{O}} $ ,盐桥中 $ {\rm {\mathrm{K}}^{+}} $ 移向装置的 (填“左侧”或“右侧”),电池的总反应为 。
(2) 用 $ {\rm {\mathrm{O}}_{2}} $ 实验:在一侧通入 $ {\rm {\mathrm{O}}_{2}} $ ,电池的总反应仍保持不变,该侧的电极反应为 。
答案:(1) 右侧; $ {\rm 2{\mathrm{H}}_{2}+{\mathrm{O}}_{2}\xlongequal{}2{\mathrm{H}}_{2}\mathrm{O}} $
(2) $ {\rm {\mathrm{O}}_{2}+4{\mathrm{e}}^{-}+2{\mathrm{H}}_{2}\mathrm{O}\xlongequal{}4{\mathrm{O}\mathrm{H}}^{-}} $
解析:(1) 用 $ {\rm {\mathrm{H}}_{2}} $ 进行实验,燃料电池中通入 $ {\rm {\mathrm{H}}_{2}} $ 的电极失电子生成 $ {\rm {\mathrm{H}}_{2}\mathrm{O}:{\mathrm{H}}_{2}-2{\mathrm{e}}^{-}+2{\mathrm{O}\mathrm{H}}^{-}\xlongequal{}2{\mathrm{H}}_{2}\mathrm{O}} $ ,该极为负极,在原电池中,阳离子向正极移动,所以盐桥中 $ {\rm {\mathrm{K}}^{+}} $ 移向正极,即右侧,氢氧燃料电池总反应为 $ {\rm 2{\mathrm{H}}_{2}+{\mathrm{O}}_{2}\xlongequal{}2{\mathrm{H}}_{2}\mathrm{O}} $ 。
(2) 用 $ {\rm {\mathrm{O}}_{2}} $ 进行实验, $ {\rm {\mathrm{O}}_{2}} $ 得电子,该电极为正极,电池总反应不变,即该电池仍是氢氧燃料电池,则通入 $ {\rm {\mathrm{O}}_{2}} $ 一侧电极反应式为 $ {\rm {\mathrm{O}}_{2}+4{\mathrm{e}}^{-}+2{\mathrm{H}}_{2}\mathrm{O}\xlongequal{}4{\mathrm{O}\mathrm{H}}^{-}} $ 。





