第六章素养检测
一、刷速度
1.下列装置工作时,将化学能转化为电能的是( )


A. 风力发电机
B. 硅太阳能电池
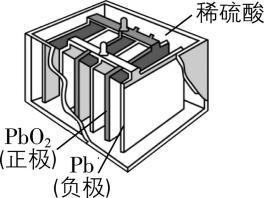

C. 铅酸蓄电池
D. 电解水装置
答案:C
解析:风力发电机是将风能转化为电能, $ {\rm \mathrm{A}} $ 错误;硅太阳能电池是将太阳能转化为电能, $ {\rm \mathrm{B}} $ 错误;铅酸蓄电池工作时是原电池,发生氧化还原反应,将化学能转化为电能, $ {\rm \mathrm{C}} $ 正确;电解水装置是将电能转化为化学能, $ {\rm \mathrm{D}} $ 错误。
2.化学反应速率和限度的研究对日常生活和工业生产有着重要意义。下列有关说法错误的是( )
A. 向炉膛内鼓风、用煤粉代替煤块都可以使炉火更旺
B. 将肉类食品进行低温冷藏,能使其永远不会腐败变质
C. 工业合成氨时,使用过量的 $ {\rm {\mathrm{N}}_{2}} $ 也不可能使 $ {\rm {\mathrm{H}}_{2}} $ 的转化率达到 $ 100\% $
D. 我国西周时期已经发明了用酒曲酿酒,其原理是催化剂能改变反应速率
答案:B
解析:相同条件下,增大反应物的浓度或增大反应物的接触面积均可加快反应速率,所以向炉膛内鼓风、用煤粉代替煤块都可以使燃烧更快,炉火更旺, $ {\rm \mathrm{A}} $ 正确;低温冷藏只能减慢肉类食品的变质速率, $ {\rm \mathrm{B}} $ 错误;工业合成氨发生的是可逆反应, $ {\rm {\mathrm{H}}_{2}} $ 不能完全转化,故 $ {\rm {\mathrm{H}}_{2}} $ 的转化率不能达到 $ 100\% $ , $ {\rm \mathrm{C}} $ 正确;酒曲中含有酶,在酿酒过程中作催化剂,能加快反应速率, $ {\rm \mathrm{D}} $ 正确。
3. $ {\rm {\mathrm{H}}_{2}} $ 和 $ {\rm {\mathrm{I}}_{2}} $ 在一定条件下能发生反应: $ {\rm {\mathrm{H}}_{2}(\mathrm{g})+{\mathrm{I}}_{2}(\mathrm{g})⇌2\mathrm{H}\mathrm{I}(\mathrm{g})} $ ,生成 $ {\rm 2\mathrm{m}\mathrm{o}\mathrm{l}\mathrm{H}\mathrm{I}(\mathrm{g})} $ 时反应放出 $ {\rm a\mathrm{k}\mathrm{J}} $ 能量( $ a $ 、 $ b $ 、 $ c $ 均大于0),下列说法正确的是( )
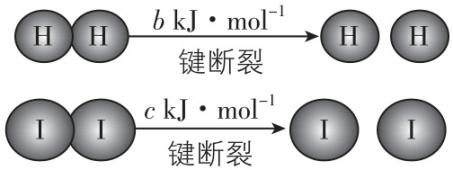
A. 反应物的总能量低于生成物的总能量
B. 断开 $ {\rm 1\mathrm{m}\mathrm{o}\mathrm{l}\mathrm{H}—\mathrm{H}} $ 和 $ {\rm 1\mathrm{m}\mathrm{o}\mathrm{l}\mathrm{I}—\mathrm{I}} $ 所需能量大于断开 $ {\rm 2\mathrm{m}\mathrm{o}\mathrm{l}\mathrm{H}—\mathrm{I}} $ 所需能量
C. 向密闭容器中加入 $ {\rm {\mathrm{H}}_{2}(\mathrm{g})} $ 和 $ {\rm {\mathrm{I}}_{2}(\mathrm{s})} $ ,生成 $ {\rm 2\mathrm{m}\mathrm{o}\mathrm{l}\mathrm{H}\mathrm{I}(\mathrm{g})} $ 放出的能量等于 $ {\rm a\mathrm{k}\mathrm{J}} $
D. 断开 $ {\rm 2\mathrm{m}\mathrm{o}\mathrm{l}\mathrm{H}—\mathrm{I}} $ 所需能量为 $ {\rm (c+b+a)\mathrm{k}\mathrm{J}} $
答案:D
解析:根据题意, $ {\rm {\mathrm{H}}_{2}(\mathrm{g})} $ 与 $ {\rm {\mathrm{I}}_{2}(\mathrm{g})} $ 反应生成 $ {\rm \mathrm{H}\mathrm{I}(\mathrm{g})} $ 放热,所以反应物的总能量比生成物的总能量高, $ {\rm \mathrm{A}} $ 错误;因为该反应为放热反应,所以断开 $ {\rm 1\mathrm{m}\mathrm{o}\mathrm{l}\mathrm{H}—\mathrm{H}} $ 和 $ {\rm 1\mathrm{m}\mathrm{o}\mathrm{l}\mathrm{I}—\mathrm{I}} $ 所需要的能量小于断开 $ {\rm 2\mathrm{m}\mathrm{o}\mathrm{l}\mathrm{H}—\mathrm{I}} $ 所需要的能量, $ {\rm \mathrm{B}} $ 错误; $ {\rm {\mathrm{I}}_{2}(\mathrm{s})\to {\mathrm{I}}_{2}(\mathrm{g})} $ 吸收能量,则 $ {\rm {\mathrm{H}}_{2}(\mathrm{g})} $ 和 $ {\rm {\mathrm{I}}_{2}(\mathrm{s})} $ 的能量低于 $ {\rm {\mathrm{H}}_{2}(\mathrm{g})} $ 和 $ {\rm {\mathrm{I}}_{2}(\mathrm{g})} $ 的能量,故 $ {\rm {\mathrm{H}}_{2}(\mathrm{g})} $ 和 $ {\rm {\mathrm{I}}_{2}(\mathrm{s})} $ 反应生成 $ {\rm 2\mathrm{m}\mathrm{o}\mathrm{l}\mathrm{H}\mathrm{I}(\mathrm{g})} $ 放出的能量小于 $ {\rm a\mathrm{k}\mathrm{J}} $ , $ {\rm \mathrm{C}} $ 错误;设断开 $ {\rm 2\mathrm{m}\mathrm{o}\mathrm{l}\mathrm{H}—\mathrm{I}} $ 所需能量为 $ {\rm x\mathrm{k}\mathrm{J}} $ ,则 $ x-(b+c)=a $ ,解得 $ x=c+b+a $ , $ {\rm \mathrm{D}} $ 正确。
4.利用如图装置可达到烟气脱硫和获得电能的目的。下列说法正确的是( )
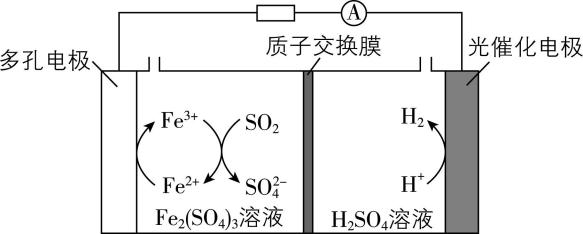
A. 多孔电极的反应式为 $ {\rm {\mathrm{S}\mathrm{O}}_{2}-2{\mathrm{e}}^{-}+2{\mathrm{H}}_{2}\mathrm{O}\xlongequal{}4{\mathrm{H}}^{+}+{\mathrm{S}\mathrm{O}}_{4}^{2-}} $
B. 工作一段时间后,右室电解质溶液的 $ {\rm \mathrm{p}\mathrm{H}} $ 增大
C. 理论上,相同条件下吸收 $ {\rm {\mathrm{S}\mathrm{O}}_{2}} $ 的体积和产生 $ {\rm {\mathrm{H}}_{2}} $ 的体积相同
D. 工作一段时间后,左室需要补充 $ {\rm {\mathrm{F}\mathrm{e}}_{2}({\mathrm{S}\mathrm{O}}_{4})_{3}} $ 溶液
答案:C
【图解】

解析:由分析可知,多孔电极上发生的反应为 $ {\rm {\mathrm{F}\mathrm{e}}^{2+}-{\mathrm{e}}^{-}\xlongequal{}{\mathrm{F}\mathrm{e}}^{3+}} $ , $ {\rm \mathrm{A}} $ 错误;负极室产生的 $ {\rm {\mathrm{H}}^{+}} $ 经质子交换膜移向正极室,根据电荷守恒可知,正极室(右室)每消耗 $ {\rm 2\mathrm{m}\mathrm{o}\mathrm{l}{\mathrm{H}}^{+}} $ ,则有 $ {\rm 2\mathrm{m}\mathrm{o}\mathrm{l}{\mathrm{H}}^{+}} $ 从左室经质子交换膜进入右室,故右室中 $ {\rm {\mathrm{H}}_{2}{\mathrm{S}\mathrm{O}}_{4}} $ 溶液的浓度保持不变, $ {\rm \mathrm{p}\mathrm{H}} $ 不变, $ {\rm \mathrm{B}} $ 错误;由图解可以得到关系式 $ {\rm {\mathrm{H}}_{2}\sim 2{\mathrm{e}}^{-}\sim 2{\mathrm{F}\mathrm{e}}^{3+}\sim {\mathrm{S}\mathrm{O}}_{2}} $ ,当电路中转移 $ 2\mathrm{m}\mathrm{o}\mathrm{l}{\mathrm{e}}^{-} $ 时,正极生成 $ {\rm 1\mathrm{m}\mathrm{o}\mathrm{l}{\mathrm{H}}_{2}} $ ,负极消耗 $ {\rm 1\mathrm{m}\mathrm{o}\mathrm{l}{\mathrm{S}\mathrm{O}}_{2}} $ ,故理论上相同条件下吸收 $ {\rm {\mathrm{S}\mathrm{O}}_{2}} $ 的体积和产生 $ {\rm {\mathrm{H}}_{2}} $ 的体积相同, $ {\rm \mathrm{C}} $ 正确; $ {\rm {\mathrm{F}\mathrm{e}}_{2}({\mathrm{S}\mathrm{O}}_{4})_{3}} $ 氧化 $ {\rm {\mathrm{S}\mathrm{O}}_{2}} $ 生成 $ {\rm {\mathrm{F}\mathrm{e}\mathrm{S}\mathrm{O}}_{4}} $ , $ {\rm {\mathrm{F}\mathrm{e}\mathrm{S}\mathrm{O}}_{4}} $ 又在电极上放电生成 $ {\rm {\mathrm{F}\mathrm{e}}_{2}({\mathrm{S}\mathrm{O}}_{4})_{3}} $ ,所以不需要补充 $ {\rm {\mathrm{F}\mathrm{e}}_{2}({\mathrm{S}\mathrm{O}}_{4})_{3}} $ 溶液, $ {\rm \mathrm{D}} $ 错误。
5.已知反应: $ {\rm 3\mathrm{A}(\mathrm{g})+\mathrm{B}(\mathrm{g})⇌x\mathrm{C}(\mathrm{g})+2\mathrm{D}(\mathrm{g})} $ ,现将等物质的量的A、B混合于 $ {\rm 2\mathrm{L}} $ 的密闭容器中反应, $ 2 \min $ 后测得D的浓度为 $ {\rm 0.5\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}} $ , $ {\rm c(\mathrm{A}):c(\mathrm{B})=3:5} $ ,以C表示的平均反应速率 $ {\rm v(\mathrm{C})=0.25\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}\cdot { \min }^{-1}} $ ,下列说法错误的是( )
A. $ x=2 $
B. $ 2 \min $ 末,C的物质的量为 $ 1\mathrm{m}\mathrm{o}\mathrm{l} $
C. $ 0\sim 2 \min $ 内,A的转化率为 $ 50\% $
D. $ 0\sim 2 \min $ 内,该反应的平均反应速率 $ {\rm v(\mathrm{A}):v(\mathrm{D})=2:3} $
答案:D
解析:由思路导引知 $ x=2 $ , $ {\rm \mathrm{A}} $ 正确;由思路导引知, $ 2 \min $ 时, $ {\rm n(\mathrm{C})=1\mathrm{m}\mathrm{o}\mathrm{l}} $ , $ {\rm \mathrm{B}} $ 正确;由思路导引知, $ {\rm \mathrm{A}} $ 的初始投料为 $ 3\mathrm{m}\mathrm{o}\mathrm{l} $ ,则 $ 0\sim 2 \min $ 内, $ {\rm \mathrm{A}} $ 的转化率为 $ \dfrac{1.5\mathrm{m}\mathrm{o}\mathrm{l}}{3\mathrm{m}\mathrm{o}\mathrm{l}}×100\%=50\% $ , $ {\rm \mathrm{C}} $ 正确;由方程式可知, $ {\rm \mathrm{A}} $ 、 $ {\rm \mathrm{D}} $ 的化学计量数比为 $ 3:2 $ ,则 $ {\rm v(\mathrm{A}):v(\mathrm{D})=3:2} $ , $ {\rm \mathrm{D}} $ 错误。
6.为探究化学反应速率的影响因素,设计实验装置。能达到相应实验目的的是( )
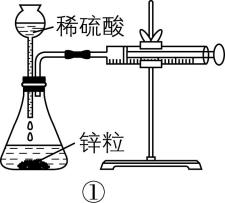
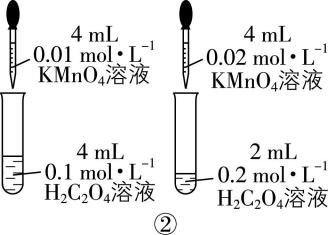
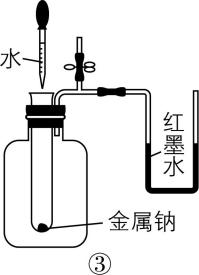
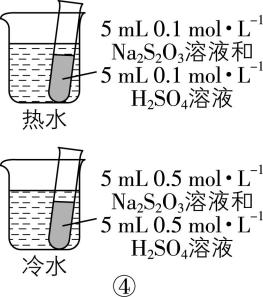
A. 装置①用于测定生成氢气的速率
B. 装置②依据褪色快慢比较浓度对反应速率的影响
C. 装置③依据 $ {\rm \mathrm{U}} $ 形管两边液面的高低判断 $ {\rm \mathrm{N}\mathrm{a}} $ 和水反应是否放热
D. 装置④依据出现浑浊的快慢比较温度对反应速率的影响
答案:C
解析:装置①生成的氢气会由长颈漏斗逸出,应用分液漏斗或将长颈漏斗插入液面以下,形成液封, $ {\rm \mathrm{A}} $ 错误;装置②依据褪色快慢比较浓度对反应速率的影响,应保证高锰酸钾溶液的浓度和体积相同,用不同浓度、相同体积的草酸来做实验, $ {\rm \mathrm{B}} $ 错误; $ {\rm \mathrm{N}\mathrm{a}} $ 和水反应放热,广口瓶内气体受热膨胀, $ {\rm \mathrm{U}} $ 形管左侧液面下降,右侧液面上升,装置③能达到目的, $ {\rm \mathrm{C}} $ 正确;装置④中浓度、温度都不同,无法判断温度对反应速率的影响, $ {\rm \mathrm{D}} $ 错误。
7. $ \mathrm{a} $ 、 $ \mathrm{b} $ 、 $ \mathrm{c} $ 、 $ \mathrm{d} $ 分别表示四种不同的纯净物气体。一定温度下,向容积为 $ {\rm 4\mathrm{L}} $ 的恒容密闭容器中通入其中两种气体,发生可逆反应,反应中各气体的物质的量变化如图所示。下列说法错误的是( )
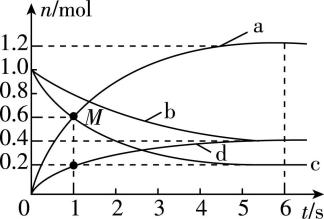
A. 容器中发生反应的化学方程式中, $ \mathrm{c} $ 与 $ \mathrm{d} $ 的化学计量数之比为 $ 2:1 $
B. $ 0\sim 1\mathrm{s} $ 内, $ \mathrm{b} $ 的平均反应速率为 $ {\rm 0.15\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}\cdot {\mathrm{s}}^{-1}} $
C. $ {\rm M} $ 点时,该反应的正反应速率大于逆反应速率
D. 从反应开始至达到平衡状态, $ \mathrm{c} $ 的转化率为 $ 80\% $
答案:B
解析:由分析可知 $ \mathrm{c} $ 与 $ \mathrm{d} $ 的化学计量数之比 $ =4:2=2:1 $ , $ {\rm \mathrm{A}} $ 正确; $ 0\sim 1\mathrm{s} $ 内, $ \mathrm{a} $ 的平均反应速率 $ {\rm =\dfrac{0.6\mathrm{m}\mathrm{o}\mathrm{l}}{4\mathrm{L}×1\mathrm{s}}=0.15\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}\cdot {\mathrm{s}}^{-1}} $ ,反应速率之比 $ = $ 化学计量数之比,则 $ \mathrm{b} $ 的平均反应速率为 $ {\rm 0.075\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}\cdot {\mathrm{s}}^{-1}} $ , $ {\rm \mathrm{B}} $ 错误; $ {\rm M} $ 点时,反应物和生成物的物质的量继续变化,反应正向进行,正反应速率大于逆反应速率, $ {\rm \mathrm{C}} $ 正确;从反应开始至达到平衡状态, $ \mathrm{c} $ 的转化量为 $ 1.0\mathrm{m}\mathrm{o}\mathrm{l}-0.2\mathrm{m}\mathrm{o}\mathrm{l}=0.8\mathrm{m}\mathrm{o}\mathrm{l} $ ,转化率 $ =\dfrac{0.8\mathrm{m}\mathrm{o}\mathrm{l}}{1.0\mathrm{m}\mathrm{o}\mathrm{l}}×100\%=80\% $ , $ {\rm \mathrm{D}} $ 正确。
8.某微生物燃料电池 $ {\rm (\mathrm{M}\mathrm{F}\mathrm{C})} $ 工作原理如图(质子交换膜只允许 $ {\rm {\mathrm{H}}^{+}} $ 通过),下列说法正确的是( )
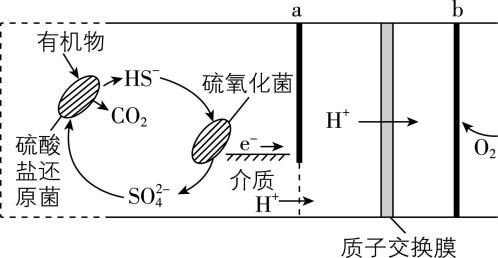
A. $ {\rm {\mathrm{H}\mathrm{S}}^{-}} $ 在硫氧化菌作用下参加的反应为 $ {\rm {\mathrm{H}\mathrm{S}}^{-}-8{\mathrm{e}}^{-}+9{\mathrm{O}\mathrm{H}}^{-}\xlongequal{}{\mathrm{S}\mathrm{O}}_{4}^{2-}+5{\mathrm{H}}_{2}\mathrm{O}} $
B. 该燃料电池在高温下进行效率更高
C. 若该电池外电路有 $ 0.4\mathrm{m}\mathrm{o}\mathrm{l} $ 电子发生转移,则有 $ {\rm 0.2\mathrm{m}\mathrm{o}\mathrm{l}{\mathrm{H}}^{+}} $ 通过质子交换膜
D. 若维持该微生物电池中两种细菌的存在,则电池可以持续供电
答案:D
解析:根据 $ {\rm {\mathrm{H}}^{+}} $ 移动方向可知 $ \mathrm{b} $ 电极为正极,电极反应式为 $ {\rm {\mathrm{O}}_{2}+4{\mathrm{e}}^{-}+4{\mathrm{H}}^{+}\xlongequal{}2{\mathrm{H}}_{2}\mathrm{O}} $ , $ \mathrm{a} $ 电极为负极,环境为酸性, $ {\rm {\mathrm{H}\mathrm{S}}^{-}} $ 在硫氧化菌作用下被氧化为 $ {\rm {\mathrm{S}\mathrm{O}}_{4}^{2-}} $ ,反应方程式为 $ {\rm {\mathrm{H}\mathrm{S}}^{-}-8{\mathrm{e}}^{-}+4{\mathrm{H}}_{2}\mathrm{O}\xlongequal{}{\mathrm{S}\mathrm{O}}_{4}^{2-}+9{\mathrm{H}}^{+}} $ , $ {\rm \mathrm{A}} $ 错误;该燃料电池是微生物燃料电池,不能在高温下进行反应, $ {\rm \mathrm{B}} $ 错误;根据电荷守恒,若该电池外电路有 $ 0.4\mathrm{m}\mathrm{o}\mathrm{l} $ 电子发生转移,则有 $ {\rm 0.4\mathrm{m}\mathrm{o}\mathrm{l}{\mathrm{H}}^{+}} $ 通过质子交换膜, $ {\rm \mathrm{C}} $ 错误;若维持该微生物电池中两种细菌的存在,则负极区 $ {\rm {\mathrm{H}\mathrm{S}}^{-}} $ 持续失电子转化为 $ {\rm {\mathrm{S}\mathrm{O}}_{4}^{2-}} $ , $ {\rm {\mathrm{S}\mathrm{O}}_{4}^{2-}} $ 持续得电子转化为 $ {\rm {\mathrm{H}\mathrm{S}}^{-}} $ ,正极氧气持续得电子,则电池可以持续供电, $ {\rm \mathrm{D}} $ 正确。
9.研究小组为探究可逆反应 $ {\rm 2{\mathrm{F}\mathrm{e}}^{2+}+{\mathrm{I}}_{2}⇌2{\mathrm{F}\mathrm{e}}^{3+}+2{\mathrm{I}}^{-}} $ ,进行以下实验。已知: $ {\rm \mathrm{A}\mathrm{g}\mathrm{S}\mathrm{C}\mathrm{N}} $ 为不溶于水的白色固体。
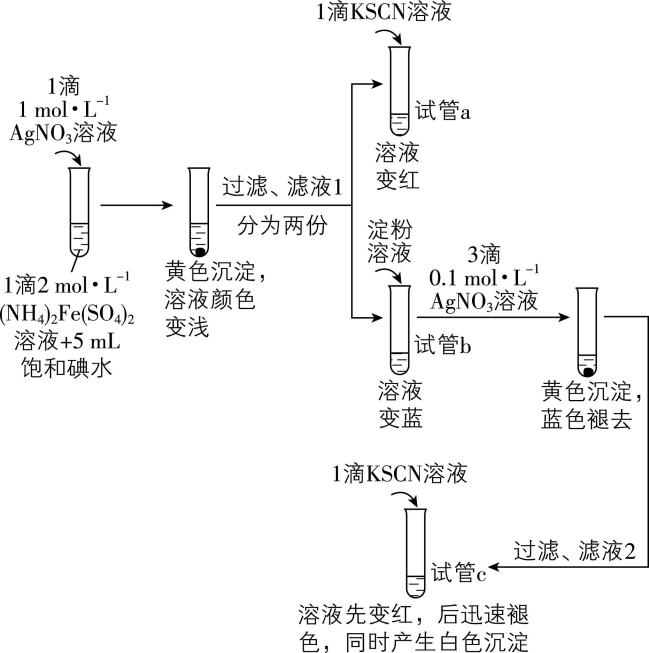
下列说法中,不正确的是( )
A. 试管 $ \mathrm{a} $ 中的现象说明滤液1中含有 $ {\rm {\mathrm{F}\mathrm{e}}^{3+}} $
B. 试管 $ \mathrm{c} $ 中的红色可能比试管 $ \mathrm{a} $ 中的深
C. 试管 $ \mathrm{a} $ 、 $ \mathrm{b} $ 中的现象证明“ $ {\rm 2{\mathrm{F}\mathrm{e}}^{2+}+{\mathrm{I}}_{2}⇌2{\mathrm{F}\mathrm{e}}^{3+}+2{\mathrm{I}}^{-}} $ ”为可逆反应
D. 试管 $ \mathrm{c} $ 中的现象说明,实验中 $ {\rm {\mathrm{S}\mathrm{C}\mathrm{N}}^{-}} $ 与 $ {\rm {\mathrm{F}\mathrm{e}}^{3+}} $ 的反应速率更快,而与 $ {\rm {\mathrm{A}\mathrm{g}}^{+}} $ 的反应限度更大
答案:C
解析:向含 $ {\rm {\mathrm{F}\mathrm{e}}^{3+}} $ 溶液中滴加 $ {\rm \mathrm{K}\mathrm{S}\mathrm{C}\mathrm{N}} $ 溶液,发生反应 $ {\rm {\mathrm{F}\mathrm{e}}^{3+}+3{\mathrm{S}\mathrm{C}\mathrm{N}}^{-}⇌\mathrm{F}\mathrm{e}(\mathrm{S}\mathrm{C}\mathrm{N})_{3}} $ ,溶液变为红色,即试管 $ \mathrm{a} $ 中现象说明滤液1中含有 $ {\rm {\mathrm{F}\mathrm{e}}^{3+}} $ , $ {\rm \mathrm{A}} $ 正确;由分析知,滤液2中 $ {\rm c({\mathrm{F}\mathrm{e}}^{3+}) >} $ 滤液1中 $ {\rm c({\mathrm{F}\mathrm{e}}^{3+})} $ ,试管 $ \mathrm{c} $ 中生成的 $ {\rm \mathrm{F}\mathrm{e}(\mathrm{S}\mathrm{C}\mathrm{N})_{3}} $ 比试管 $ \mathrm{a} $ 中多,红色更深, $ {\rm \mathrm{B}} $ 正确; $ {\rm ({\mathrm{N}\mathrm{H}}_{4})_{2}\mathrm{F}\mathrm{e}({\mathrm{S}\mathrm{O}}_{4})_{2}} $ 与 $ {\rm {\mathrm{I}}_{2}} $ 反应,饱和碘水过量, $ {\rm {\mathrm{F}\mathrm{e}}^{2+}} $ 不足,试管 $ \mathrm{a} $ 和 $ \mathrm{b} $ 中的现象只能证明滤液1中含 $ {\rm {\mathrm{F}\mathrm{e}}^{3+}} $ 、 $ {\rm {\mathrm{I}}_{2}} $ ,不能证明 $ {\rm {\mathrm{F}\mathrm{e}}^{2+}} $ 存在,因此试管 $ \mathrm{a} $ 和 $ \mathrm{b} $ 中的现象只能证明存在 $ {\rm 2{\mathrm{F}\mathrm{e}}^{2+}+{\mathrm{I}}_{2}⇌2{\mathrm{F}\mathrm{e}}^{3+}+2{\mathrm{I}}^{-}} $ 的正反应,不能证明反应可逆, $ {\rm \mathrm{C}} $ 错误;由题中信息知,试管 $ \mathrm{c} $ 中生成的白色沉淀为 $ {\rm \mathrm{A}\mathrm{g}\mathrm{S}\mathrm{C}\mathrm{N}} $ ,试管 $ \mathrm{c} $ 中溶液先变红说明 $ {\rm {\mathrm{S}\mathrm{C}\mathrm{N}}^{-}} $ 与 $ {\rm {\mathrm{F}\mathrm{e}}^{3+}} $ 反应速率更快,后迅速褪色,同时产生白色沉淀,说明 $ {\rm {\mathrm{S}\mathrm{C}\mathrm{N}}^{-}} $ 与 $ {\rm {\mathrm{A}\mathrm{g}}^{+}} $ 反应限度更大, $ {\rm \mathrm{D}} $ 正确。
10.一定温度下,在容积为 $ {\rm V\mathrm{L}} $ 的密闭容器中进行反应, $ {\rm \mathrm{M}} $ 、 $ {\rm \mathrm{N}} $ 两种气体的物质的量随时间的变化曲线如图所示:
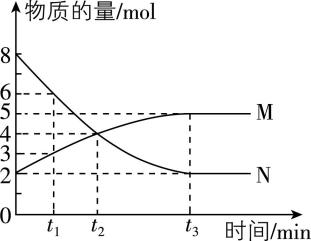
(1) 该反应的化学方程式是 。
(2) $ {t}_{1}\sim {t}_{2} \min $ ,以 $ {\rm \mathrm{M}} $ 的浓度变化表示的平均反应速率为 。
(3) 若达到平衡状态的时间是 $ 4 \min $ , $ {\rm \mathrm{N}} $ 在该 $ 4 \min $ 内的平均反应速率为 $ {\rm 1.5\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}\cdot { \min }^{-1}} $ ,则此容器的容积为 $ {\rm \mathrm{L}} $ 。
(4) 反应 $ {\rm \mathrm{A}(\mathrm{g})+\mathrm{B}(\mathrm{g})⇌2\mathrm{C}(\mathrm{g})} $ ,当改变下列条件时,会加快反应速率的是 (填序号)。
①降低温度 ②保持容器的容积不变,充入氦气 ③加入催化剂 ④保持容器的容积不变,增加 $ {\rm \mathrm{A}(\mathrm{g})} $ 的物质的量
答案:(1) $ {\rm 2\mathrm{N}⇌\mathrm{M}} $
(2) $ {\rm \dfrac{1}{({t}_{2}-{t}_{1})V}\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}\cdot { \min }^{-1}} $
(3) 1
(4) ③④
解析:(1) 由题图可知,反应过程中 $ {\rm \mathrm{N}} $ 的物质的量减小, $ {\rm \mathrm{M}} $ 的物质的量增大,因此 $ {\rm \mathrm{N}} $ 为反应物, $ {\rm \mathrm{M}} $ 为生成物,反应物未完全转化为生成物,因此该反应为可逆反应,相同时间内 $ {\rm \mathrm{\Delta }n(\mathrm{N})=2\mathrm{\Delta }n(\mathrm{M})} $ ,因此该反应的化学方程式为 $ {\rm 2\mathrm{N}⇌\mathrm{M}} $ 。
(2) $ {t}_{1}\sim {t}_{2} \min $ , $ {\rm \mathrm{\Delta }n(\mathrm{M})=4\mathrm{m}\mathrm{o}\mathrm{l}-3\mathrm{m}\mathrm{o}\mathrm{l}=1\mathrm{m}\mathrm{o}\mathrm{l}} $ ,容器容积为 $ {\rm V\mathrm{L}} $ ,因此以 $ {\rm \mathrm{M}} $ 的浓度变化表示的平均反应速率 $ {\rm v(\mathrm{M})=\dfrac{\dfrac{1\mathrm{m}\mathrm{o}\mathrm{l}}{V\mathrm{L}}}{({t}_{2}-{t}_{1}) \min }=\dfrac{1}{({t}_{2}-{t}_{1})V}\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}\cdot { \min }^{-1}} $ 。
(3) 若达到平衡状态的时间是 $ 4 \min $ ,前 $ 4 \min $ 内 $ {\rm \mathrm{\Delta }n(\mathrm{N})=8\mathrm{m}\mathrm{o}\mathrm{l}-2\mathrm{m}\mathrm{o}\mathrm{l}=6\mathrm{m}\mathrm{o}\mathrm{l}} $ ,已知 $ {\rm \mathrm{N}} $ 在该 $ 4 \min $ 内的平均反应速率 $ {\rm v(\mathrm{N})=\dfrac{\dfrac{6\mathrm{m}\mathrm{o}\mathrm{l}}{V\mathrm{L}}}{4 \min }=\dfrac{1.5}{V}\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}\cdot { \min }^{-1}=1.5\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}\cdot { \min }^{-1}} $ ,则 $ {\rm V=1} $ ,容器的容积为 $ {\rm 1\mathrm{L}} $ 。
(4) ①降低温度会使化学反应速率减慢;②保持容器的容积不变,充入氦气,反应物的浓度不变,化学反应速率不变;③加入催化剂能使化学反应速率加快;④保持容器的容积不变,增加 $ {\rm \mathrm{A}(\mathrm{g})} $ 的物质的量,反应物浓度增大,化学反应速率加快,故答案为③④。
11.Ⅰ.在恒温条件下将一定量 $ {\rm \mathrm{M}} $ 和 $ {\rm \mathrm{N}} $ 的混合气体通入容积为 $ {\rm 2\mathrm{L}} $ 的密闭容器中, $ {\rm \mathrm{M}} $ 和 $ {\rm \mathrm{N}} $ 的物质的量随时间的变化情况如图所示。
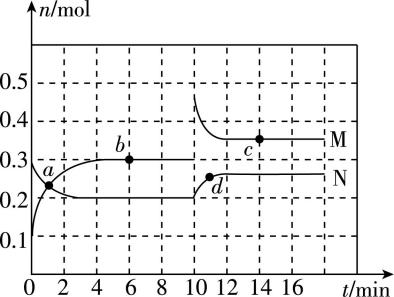
(1) 该反应的化学方程式为 (反应物和生成物用符号 $ {\rm \mathrm{M}} $ 、 $ {\rm \mathrm{N}} $ 表示)。
(2) 反应开始至 $ 4 \min $ , $ {\rm \mathrm{M}} $ 的平均反应速率为 。
(3) $ a $ 、 $ b $ 、 $ c $ 、 $ d $ 四个点中,表示化学反应处于平衡状态的点是 。
Ⅱ.在恒温条件下,将 $ {\rm a\mathrm{m}\mathrm{o}\mathrm{l}{\mathrm{N}}_{2}} $ 与 $ {\rm a\mathrm{m}\mathrm{o}\mathrm{l}{\mathrm{H}}_{2}} $ 的混合气体通入一个固定容积的密闭容器中,发生如下反应: $ {\rm {\mathrm{N}}_{2}(\mathrm{g})+3{\mathrm{H}}_{2}(\mathrm{g})\stackrel{高温{、}高压}{\underset{催化剂}{⇌}}2{\mathrm{N}\mathrm{H}}_{3}(\mathrm{g})} $ 。
(4) 反应进行到某时刻 $ t $ 时, $ {\rm {n}_{t}({\mathrm{N}}_{2})=10\mathrm{m}\mathrm{o}\mathrm{l}} $ , $ {\rm {n}_{t}({\mathrm{N}\mathrm{H}}_{3})=6\mathrm{m}\mathrm{o}\mathrm{l}} $ ,则 $ a $ 的值为 。
(5) 在合成氨过程中,正反应是放热反应。下列有关说法错误的是 (填序号)。
$ \mathrm{a} $ .使用催化剂是为了提高正反应速率,提高生产效率
$ \mathrm{b} $ .在上述条件下, $ {\rm {\mathrm{N}}_{2}} $ 不可能 $ 100\% $ 地转化为 $ {\rm {\mathrm{N}\mathrm{H}}_{3}} $
$ \mathrm{c} $ .通过控制反应条件,不能提高该反应进行的程度
答案:(1) $ {\rm \mathrm{N}⇌2\mathrm{M}} $
(2) $ {\rm 0.025\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}\cdot { \min }^{-1}} $
(3) $ b $ 、 $ c $
(4) 13
(5) $ \mathrm{c} $
解析:(1) 由题图可知,该反应为可逆反应, $ {\rm \mathrm{N}} $ 为反应物、 $ {\rm \mathrm{M}} $ 为生成物, $ {\rm \mathrm{N}} $ 和 $ {\rm \mathrm{M}} $ 的物质的量变化量之比为 $ (0.3\mathrm{m}\mathrm{o}\mathrm{l}-0.2\mathrm{m}\mathrm{o}\mathrm{l}):(0.3\mathrm{m}\mathrm{o}\mathrm{l}-0.1\mathrm{m}\mathrm{o}\mathrm{l})=1:2 $ ,由物质的量变化量之比等于化学计量数之比可知,反应的化学方程式为 $ {\rm \mathrm{N}⇌2\mathrm{M}} $ 。
(2) 由题图可知, $ 4 \min $ 时, $ {\rm \mathrm{M}} $ 的物质的量为 $ 0.3\mathrm{m}\mathrm{o}\mathrm{l} $ ,则反应开始至 $ 4 \min $ , $ {\rm \mathrm{M}} $ 的平均反应速率为 $ {\rm \dfrac{\dfrac{0.3\mathrm{m}\mathrm{o}\mathrm{l}-0.1\mathrm{m}\mathrm{o}\mathrm{l}}{2\mathrm{L}}}{4 \min }=0.025\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}\cdot { \min }^{-1}} $ 。
(3) 由题图可知, $ a $ 、 $ d $ 点后 $ {\rm \mathrm{M}} $ 和 $ {\rm \mathrm{N}} $ 的量继续改变,说明反应没有达到平衡状态; $ b $ 、 $ c $ 点后 $ {\rm \mathrm{M}} $ 和 $ {\rm \mathrm{N}} $ 的量不再改变,说明反应达到平衡状态,则表示化学反应处于平衡状态的点是 $ b $ 、 $ c $ 。
(4) 由题意可知,时刻 $ t $ 时,氮气、氨气的物质的量分别为 $ 10\mathrm{m}\mathrm{o}\mathrm{l} $ 、 $ 6\mathrm{m}\mathrm{o}\mathrm{l} $ ,由化学方程式可知 $ {\rm 2\mathrm{\Delta }n({\mathrm{N}}_{2})=\mathrm{\Delta }n({\mathrm{N}\mathrm{H}}_{3})} $ ,则 $ (a-10)\mathrm{m}\mathrm{o}\mathrm{l}×2=6\mathrm{m}\mathrm{o}\mathrm{l} $ ,解得 $ a=13 $ 。
(5) 使用催化剂可以提高正、逆反应速率,提高单位时间内生成物的物质的量变化量,从而达到提高生产效率的目的, $ \mathrm{a} $ 正确;该反应是可逆反应,可逆反应不可能完全反应,所以在题述条件下,氮气不可能 $ 100\% $ 地转化为氨气, $ \mathrm{b} $ 正确;该反应是可逆反应,通过控制反应条件,使平衡向正反应方向移动,能达到提高反应进行程度的目的, $ \mathrm{c} $ 错误。
12.近年来,我国化工技术获得重大突破,利用合成气(主要成分为 $ {\rm \mathrm{C}\mathrm{O}} $ 、 $ {\rm {\mathrm{C}\mathrm{O}}_{2}} $ 和 $ {\rm {\mathrm{H}}_{2}} $ )在催化剂的作用下合成甲醇 $ {\rm ({\mathrm{C}\mathrm{H}}_{3}\mathrm{O}\mathrm{H})} $ 是其中的一个研究项目,该研究发生的主要反应如下:
Ⅰ $ {\rm . \mathrm{C}\mathrm{O}} $ 与 $ {\rm {\mathrm{H}}_{2}} $ 反应合成甲醇: $ {\rm \mathrm{C}\mathrm{O}(\mathrm{g})+2{\mathrm{H}}_{2}(\mathrm{g})⇌{\mathrm{C}\mathrm{H}}_{3}\mathrm{O}\mathrm{H}(\mathrm{g})} $
Ⅱ $ {\rm . {\mathrm{C}\mathrm{O}}_{2}} $ 与 $ {\rm {\mathrm{H}}_{2}} $ 反应合成甲醇: $ {\rm {\mathrm{C}\mathrm{O}}_{2}(\mathrm{g})+3{\mathrm{H}}_{2}(\mathrm{g})⇌{\mathrm{C}\mathrm{H}}_{3}\mathrm{O}\mathrm{H}(\mathrm{g})+{\mathrm{H}}_{2}\mathrm{O}(\mathrm{g})} $
(1) 上述反应符合原子经济性的是反应 (填“Ⅰ”或“Ⅱ”)。
(2) 在某一时刻采取下列措施,能使反应Ⅰ的反应速率减小的是 (填序号,下同)。
A. 恒温恒容下,再充入 $ {\rm \mathrm{C}\mathrm{O}} $
B. 降低温度
C. 恒温恒容下,向其中充入 $ {\rm \mathrm{A}\mathrm{r}} $
(3) 一定温度下,在容积固定的密闭容器中发生反应Ⅱ,下列说法可以表明反应达到化学平衡状态的是 。
A. 单位时间内消耗 $ {\rm 3\mathrm{m}\mathrm{o}\mathrm{l}{\mathrm{H}}_{2}} $ ,同时生成 $ 1\mathrm{m}\mathrm{o}\mathrm{l} $ 的 $ {\rm {\mathrm{C}\mathrm{H}}_{3}\mathrm{O}\mathrm{H}} $
B. $ {\rm {\mathrm{C}\mathrm{H}}_{3}\mathrm{O}\mathrm{H}} $ 的体积分数不再发生变化
C. $ {\rm 3v({\mathrm{C}\mathrm{O}}_{2})=v({\mathrm{H}}_{2})} $
D. 容器内气体密度不再改变
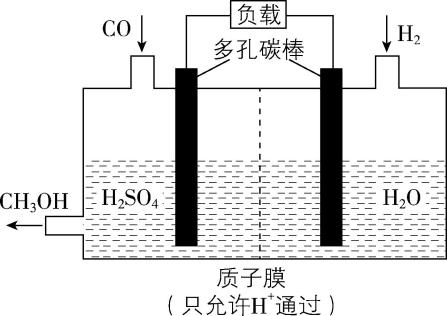
(4) $ {\rm {\mathrm{H}}_{2}} $ 还原 $ {\rm \mathrm{C}\mathrm{O}} $ 电化学法制备甲醇 $ {\rm (\mathrm{C}\mathrm{O}+2{\mathrm{H}}_{2}\xlongequal{}{\mathrm{C}\mathrm{H}}_{3}\mathrm{O}\mathrm{H})} $ 的工作原理如图所示。通入 $ {\rm {\mathrm{H}}_{2}} $ 的一端是电池 (填“正”或“负”)极,发生的电极反应为 ;电池工作过程中 $ {\rm {\mathrm{H}}^{+}} $ 通过质子膜向 (填“左”或“右”)移动。
(5) 工业上通过反应Ⅱ制备 $ {\rm {\mathrm{C}\mathrm{H}}_{3}\mathrm{O}\mathrm{H}:} $ 在 $ {\rm 2\mathrm{L}} $ 恒容密闭容器中,将 $ {\rm 2\mathrm{m}\mathrm{o}\mathrm{l}{\mathrm{C}\mathrm{O}}_{2}} $ 和 $ {\rm 6\mathrm{m}\mathrm{o}\mathrm{l}{\mathrm{H}}_{2}} $ 混合,反应过程中反应物和生成物的物质的量数据见表:
反应时间/ $ \min $ | $ {\rm {\mathrm{C}\mathrm{O}}_{2}/\mathrm{m}\mathrm{o}\mathrm{l}} $ | $ {\rm {\mathrm{H}}_{2}/\mathrm{m}\mathrm{o}\mathrm{l}} $ | $ {\rm {\mathrm{C}\mathrm{H}}_{3}\mathrm{O}\mathrm{H}/\mathrm{m}\mathrm{o}\mathrm{l}} $ |
0 | 2 | 6 | 0 |
5 | 1 | | |
15 | | 1.5 | |
20 | | | 1.5 |
$ 0\sim 5 \min $ 内反应平均速率 $ {\rm v({\mathrm{H}}_{2})=} $ ,反应达平衡时, $ {\rm {\mathrm{C}\mathrm{O}}_{2}} $ 的转化率为 , $ 15 \min $ 时 $ {\rm {\mathrm{C}\mathrm{H}}_{3}\mathrm{O}\mathrm{H}} $ 的物质的量浓度为 。
答案:(1) Ⅰ
(2) B
(3) B
(4) 负; $ {\rm {\mathrm{H}}_{2}-2{\mathrm{e}}^{-}\xlongequal{}2{\mathrm{H}}^{+}} $ ;左
(5) $ {\rm 0.3\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}\cdot { \min }^{-1}} $ ; $ 75\% $ ; $ {\rm 0.75\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}} $
解析:(1) 原子经济性是指反应物原子全部转化为目标产物,反应Ⅰ中反应物原子全部转化为 $ {\rm {\mathrm{C}\mathrm{H}}_{3}\mathrm{O}\mathrm{H}} $ ,反应Ⅱ除生成 $ {\rm {\mathrm{C}\mathrm{H}}_{3}\mathrm{O}\mathrm{H}} $ 外还生成 $ {\rm {\mathrm{H}}_{2}\mathrm{O}} $ ,所以符合原子经济性的是反应Ⅰ。
(2) 恒温恒容下,再充入 $ {\rm \mathrm{C}\mathrm{O}} $ ,反应物浓度增大,反应速率加快, $ {\rm \mathrm{A}} $ 错误;降低温度,反应速率减小, $ {\rm \mathrm{B}} $ 正确;恒温恒容下,充入 $ {\rm \mathrm{A}\mathrm{r}} $ ,反应物、生成物浓度不变,反应速率不变, $ {\rm \mathrm{C}} $ 错误。
(3) 单位时间内消耗 $ {\rm 3\mathrm{m}\mathrm{o}\mathrm{l}{\mathrm{H}}_{2}} $ ,同时生成 $ {\rm 1\mathrm{m}\mathrm{o}\mathrm{l}{\mathrm{C}\mathrm{H}}_{3}\mathrm{O}\mathrm{H}} $ ,都体现正反应速率,不能说明反应达到平衡状态, $ {\rm \mathrm{A}} $ 错误; $ {\rm {\mathrm{C}\mathrm{H}}_{3}\mathrm{O}\mathrm{H}} $ 的体积分数不再发生变化,说明各物质浓度不变,反应达到平衡状态, $ {\rm \mathrm{B}} $ 正确; $ {\rm 3v({\mathrm{C}\mathrm{O}}_{2})=v({\mathrm{H}}_{2})} $ ,未指明反应速率对应的反应方向,不能说明反应达到平衡状态, $ {\rm \mathrm{C}} $ 错误;反应在容积固定的密闭容器中进行,气体体积不变,反应物和生成物都是气体,由质量守恒可知气体质量不变,则气体密度始终不变,恒量不变不能说明反应达到平衡状态, $ {\rm \mathrm{D}} $ 错误。
(4) 由反应原理可知 $ {\rm \mathrm{H}} $ 的化合价升高, $ {\rm {\mathrm{H}}_{2}} $ 发生氧化反应,所以通入 $ {\rm {\mathrm{H}}_{2}} $ 的一端是电池的负极, $ {\rm {\mathrm{H}}_{2}} $ 失去电子生成 $ {\rm {\mathrm{H}}^{+}} $ ,电极反应为 $ {\rm {\mathrm{H}}_{2}-2{\mathrm{e}}^{-}\xlongequal{}2{\mathrm{H}}^{+}} $ ;电池工作时,阳离子 $ {\rm ({\mathrm{H}}^{+})} $ 向正极移动,通入 $ {\rm \mathrm{C}\mathrm{O}} $ 的一端是正极,所以 $ {\rm {\mathrm{H}}^{+}} $ 通过质子膜向左移动。
(5) 根据反应 $ {\rm {\mathrm{C}\mathrm{O}}_{2}(\mathrm{g})+3{\mathrm{H}}_{2}(\mathrm{g})⇌{\mathrm{C}\mathrm{H}}_{3}\mathrm{O}\mathrm{H}(\mathrm{g})+{\mathrm{H}}_{2}\mathrm{O}(\mathrm{g})} $ 及表格数据可知, $ 0\sim 5 \min $ 内, $ {\rm \mathrm{\Delta }n({\mathrm{C}\mathrm{O}}_{2})=2\mathrm{m}\mathrm{o}\mathrm{l}-1\mathrm{m}\mathrm{o}\mathrm{l}=1\mathrm{m}\mathrm{o}\mathrm{l}} $ ,根据化学计量数之比,可得 $ {\rm \mathrm{\Delta }n({\mathrm{H}}_{2})=3\mathrm{\Delta }n({\mathrm{C}\mathrm{O}}_{2})=3\mathrm{m}\mathrm{o}\mathrm{l}} $ ,容器容积 $ {\rm V=2\mathrm{L}} $ ,根据反应速率公式 $ {\rm v=\dfrac{\mathrm{\Delta }c}{\mathrm{\Delta }t}=\dfrac{\mathrm{\Delta }n}{V\mathrm{\Delta }t}} $ ,可得 $ {\rm v({\mathrm{H}}_{2})=\dfrac{3\mathrm{m}\mathrm{o}\mathrm{l}}{2\mathrm{L}×5 \min }=0.3\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}\cdot { \min }^{-1}} $ ; $ 20 \min $ 时, $ {\rm n({\mathrm{C}\mathrm{H}}_{3}\mathrm{O}\mathrm{H})=1.5\mathrm{m}\mathrm{o}\mathrm{l}} $ ,根据化学计量数关系, $ {\rm \mathrm{\Delta }n({\mathrm{C}\mathrm{O}}_{2})=\mathrm{\Delta }n({\mathrm{C}\mathrm{H}}_{3}\mathrm{O}\mathrm{H})=1.5\mathrm{m}\mathrm{o}\mathrm{l}} $ , $ {\rm \mathrm{\Delta }n({\mathrm{H}}_{2})=3\mathrm{\Delta }n({\mathrm{C}\mathrm{H}}_{3}\mathrm{O}\mathrm{H})=4.5\mathrm{m}\mathrm{o}\mathrm{l}} $ ,此时剩余 $ {\rm {\mathrm{H}}_{2}} $ 物质的量 $ {\rm n({\mathrm{H}}_{2})=1.5\mathrm{m}\mathrm{o}\mathrm{l}} $ ,则 $ 15 \min $ 时反应已达到平衡状态,起始 $ {\rm n({\mathrm{C}\mathrm{O}}_{2})=2\mathrm{m}\mathrm{o}\mathrm{l}} $ ,转化率 $ {\rm \alpha ({\mathrm{C}\mathrm{O}}_{2})=\dfrac{转化量}{起始量}×100\%=\dfrac{1.5\mathrm{m}\mathrm{o}\mathrm{l}}{2\mathrm{m}\mathrm{o}\mathrm{l}}×100\%=75\%} $ ; $ 15 \min $ 时,反应已达平衡状态,此时 $ {\rm n({\mathrm{C}\mathrm{H}}_{3}\mathrm{O}\mathrm{H})} $ 与 $ 20 \min $ 时相等,均为 $ 1.5\mathrm{m}\mathrm{o}\mathrm{l} $ ,容器容积为 $ {\rm 2\mathrm{L}} $ ,则 $ {\rm c({\mathrm{C}\mathrm{H}}_{3}\mathrm{O}\mathrm{H})=\dfrac{1.5\mathrm{m}\mathrm{o}\mathrm{l}}{2\mathrm{L}}=0.75\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}} $ 。
















