专题3 化学反应速率的数据及图像分析
一、刷难关
1.向某恒容密闭容器中充入一定量的气体A和气体B,发生反应: $ {\rm \mathrm{A}(\mathrm{g})+\mathrm{B}(\mathrm{g})⇌\mathrm{C}(\mathrm{g})+\mathrm{D}(\mathrm{g})} $ ,正反应速率随时间变化的曲线如图所示。下列说法错误的是( )
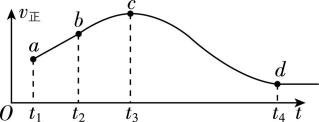
A. $ {t}_{1} $ 时刻反应物的浓度大于 $ {t}_{2} $ 时刻反应物的浓度
B. 逆反应速率在 $ {t}_{3} $ 时刻达到最大
C. 反应在 $ {t}_{4} $ 时刻后处于化学平衡状态
D. $ {t}_{1}\sim {t}_{3} $ 正反应速率升高的原因可能是此反应放热
答案:B
解析:随着反应的进行,反应物浓度减小,因此 $ {t}_{1} $ 时刻反应物浓度大于 $ {t}_{2} $ 时刻反应物浓度, $ {\rm \mathrm{A}} $ 正确;开始时,逆反应速率为零,平衡时逆反应速率最大, $ {t}_{4} $ 时刻之后,正反应速率不变,则反应在 $ {t}_{4} $ 时刻后处于化学平衡状态,因此逆反应速率在 $ {t}_{4} $ 时刻达到最大, $ {\rm \mathrm{B}} $ 错误, $ {\rm \mathrm{C}} $ 正确; $ c $ 点之前,正反应速率增大,而反应物浓度减小,说明该阶段使反应速率增大的原因不是浓度,可能是温度,则该反应放热, $ {\rm \mathrm{D}} $ 正确。
2.一定条件下, $ {\rm {\mathrm{H}}_{2}\mathrm{O}(\mathrm{g})} $ 在某催化剂表面上发生分解反应生成 $ {\rm {\mathrm{H}}_{2}} $ 和 $ {\rm {\mathrm{O}}_{2}} $ ,反应过程中实验数据如图所示。下列叙述正确的是( )
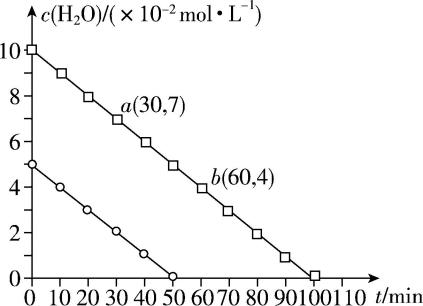
已知:化学上,将反应物消耗一半所用的时间称为半衰期 $ ({t}_{\frac{1}{2}}) $ 。
A. $ {\rm {\mathrm{H}}_{2}\mathrm{O}(\mathrm{g})} $ 在该催化剂表面的分解反应是可逆反应
B. $ {\rm {\mathrm{H}}_{2}\mathrm{O}(\mathrm{g})} $ 的半衰期与起始浓度成反比
C. 在该催化剂表面 $ {\rm {\mathrm{H}}_{2}\mathrm{O}(\mathrm{g})} $ 分解反应先快后慢
D. $ ab $ 段 $ {\rm {\mathrm{O}}_{2}(\mathrm{g})} $ 的平均生成速率为 $ {\rm 5.0×{10}^{-4}\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}\cdot { \min }^{-1}} $
答案:D
解析:由图像可知, $ {\rm {\mathrm{H}}_{2}\mathrm{O}(\mathrm{g})} $ 最终浓度为0,说明 $ {\rm {\mathrm{H}}_{2}\mathrm{O}(\mathrm{g})} $ 能完全分解,该反应不是可逆反应, $ {\rm \mathrm{A}} $ 错误;由图像可知,两条线的斜率相同, $ {\rm {\mathrm{H}}_{2}\mathrm{O}(\mathrm{g})} $ 的起始浓度 $ {\rm c({\mathrm{H}}_{2}\mathrm{O})=10×{10}^{-2}\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}} $ 时,半衰期为 $ 50 \min $ , $ {\rm {\mathrm{H}}_{2}\mathrm{O}(\mathrm{g})} $ 的起始浓度 $ {\rm c({\mathrm{H}}_{2}\mathrm{O})=5×{10}^{-2}\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}} $ 时,半衰期为 $ 25 \min $ , $ {\rm {\mathrm{H}}_{2}\mathrm{O}(\mathrm{g})} $ 的半衰期与起始浓度成正比, $ {\rm \mathrm{B}} $ 错误;由图像可知, $ {\rm {\mathrm{H}}_{2}\mathrm{O}} $ 的分解速率在各时间段内相等,即 $ {\rm {\mathrm{H}}_{2}\mathrm{O}(\mathrm{g})} $ 分解反应速率不随时间改变而改变, $ {\rm \mathrm{C}} $ 错误; $ ab $ 段 $ {\rm {\mathrm{H}}_{2}\mathrm{O}(\mathrm{g})} $ 的消耗速率 $ {\rm v({\mathrm{H}}_{2}\mathrm{O})=\dfrac{\mathrm{\Delta }c}{\mathrm{\Delta }t}=\dfrac{3×{10}^{-2}\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}}{30 \min }=1.0×{10}^{-3}\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}\cdot { \min }^{-1}} $ ,根据不同物质反应速率之比等于化学计量数之比得 $ {\rm v({\mathrm{O}}_{2})=\dfrac{1}{2}v({\mathrm{H}}_{2}\mathrm{O})=5.0×{10}^{-4}\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}\cdot { \min }^{-1}} $ , $ {\rm \mathrm{D}} $ 正确。
3.某化学小组欲测定酸性条件下 $ {\rm {\mathrm{K}\mathrm{C}\mathrm{l}\mathrm{O}}_{3}} $ 溶液与 $ {\rm {\mathrm{N}\mathrm{a}\mathrm{H}\mathrm{S}\mathrm{O}}_{3}} $ 溶液反应的速率,所用的试剂为 $ {\rm 10\mathrm{m}\mathrm{L}0.1\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}{\mathrm{K}\mathrm{C}\mathrm{l}\mathrm{O}}_{3}} $ 溶液和 $ {\rm 10\mathrm{m}\mathrm{L}0.3\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}{\mathrm{N}\mathrm{a}\mathrm{H}\mathrm{S}\mathrm{O}}_{3}} $ 溶液,所得 $ {\rm c({\mathrm{C}\mathrm{l}}^{-})} $ 随时间变化的曲线如图所示。已知: $ {\rm {\mathrm{C}\mathrm{l}\mathrm{O}}_{3}^{-}+3{\mathrm{H}\mathrm{S}\mathrm{O}}_{3}^{-}\xlongequal{}{\mathrm{C}\mathrm{l}}^{-}+3{\mathrm{S}\mathrm{O}}_{4}^{2-}+3{\mathrm{H}}^{+}} $ ,下列说法不正确的是( )
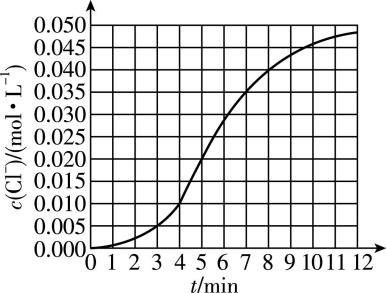
A. 该反应在 $ 0\sim 4 \min $ 的化学反应速率 $ {\rm v({\mathrm{C}\mathrm{l}\mathrm{O}}_{3}^{-})=2.5×{10}^{-3}\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}\cdot { \min }^{-1}} $
B. $ 5 \min $ 时,反应中 $ {\rm 3v({\mathrm{C}\mathrm{l}}^{-})=v({\mathrm{H}\mathrm{S}\mathrm{O}}_{3}^{-})} $
C. 在反应过程中,随着反应物浓度的减小,该反应的反应速率在逐渐减小
D. 该反应可能是放热反应
答案:C
解析:根据图像, $ 0\sim 4 \min $ 内氯离子浓度增加 $ {\rm 0.01\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}} $ ,则 $ {\rm {\mathrm{C}\mathrm{l}\mathrm{O}}_{3}^{-}} $ 的浓度减小 $ {\rm 0.01\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}} $ ,该反应在 $ 0\sim 4 \min $ 的化学反应速率 $ {\rm v({\mathrm{C}\mathrm{l}\mathrm{O}}_{3}^{-})=\dfrac{0.01\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}}{4 \min }=2.5×{10}^{-3}\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}\cdot { \min }^{-1}} $ , $ {\rm \mathrm{A}} $ 正确;用不同物质表示的反应速率比等于化学计量数之比, $ 5 \min $ 时反应中 $ {\rm 3v({\mathrm{C}\mathrm{l}}^{-})=v({\mathrm{H}\mathrm{S}\mathrm{O}}_{3}^{-})} $ , $ {\rm \mathrm{B}} $ 正确;根据图像,在反应过程中,该反应的反应速率先增大后减小, $ {\rm \mathrm{C}} $ 错误;一段时间后反应速率明显增大,可能是生成的氯离子或硫酸根离子可催化该反应使反应速率加快,也可能是反应放热,温度升高使反应速率加快, $ {\rm \mathrm{D}} $ 正确。
4. $ {\rm {\mathrm{N}\mathrm{O}}_{2}} $ 的储存和还原技术能有效减少柴油发动机在空气过量时排放的 $ {\rm {\mathrm{N}\mathrm{O}}_{2}} $ ,其原理如图甲所示。用 $ {\rm {\mathrm{H}}_{2}} $ 模拟尾气中的还原性气体研究 $ {\rm \mathrm{B}\mathrm{a}({\mathrm{N}\mathrm{O}}_{3})_{2}} $ 的催化还原过程,反应中各物质的浓度随时间的变化如图乙所示。
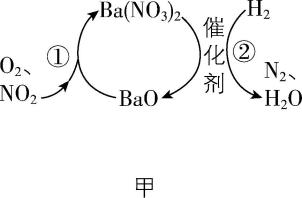
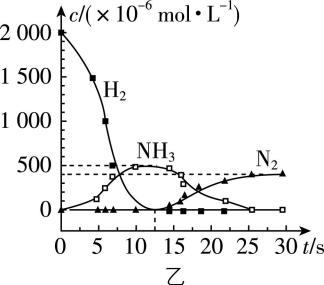
下列说法不正确的是( )
A. 反应①为 $ {\rm 4{\mathrm{N}\mathrm{O}}_{2}+{\mathrm{O}}_{2}+2\mathrm{B}\mathrm{a}\mathrm{O}\xlongequal{}2\mathrm{B}\mathrm{a}({\mathrm{N}\mathrm{O}}_{3})_{2}} $
B. 该储存和还原技术也能减少尾气排放的 $ {\rm \mathrm{N}\mathrm{O}} $
C. $ 0~12.5\mathrm{s} $ 内,氢气的消耗速率 $ {\rm v({\mathrm{H}}_{2})=1.6×{10}^{-4}\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}\cdot {\mathrm{s}}^{-1}} $
D. 反应②分两步进行,第二步 $ {\rm \mathrm{B}\mathrm{a}({\mathrm{N}\mathrm{O}}_{3})_{2}} $ 的消耗速率大于第一步的
答案:D
解析:根据题图甲可知,反应①中反应物为氧化钡、二氧化氮和氧气,生成物为硝酸钡,其化学方程式为 $ {\rm 4{\mathrm{N}\mathrm{O}}_{2}+{\mathrm{O}}_{2}+2\mathrm{B}\mathrm{a}\mathrm{O}\xlongequal{}2\mathrm{B}\mathrm{a}({\mathrm{N}\mathrm{O}}_{3})_{2}} $ , $ {\rm \mathrm{A}} $ 正确; $ {\rm {\mathrm{N}\mathrm{O}}_{2}} $ 的储存和还原技术能有效减少柴油发动机在空气过量时排放的 $ {\rm {\mathrm{N}\mathrm{O}}_{2}} $ , $ {\rm \mathrm{N}\mathrm{O}} $ 和氧气反应生成 $ {\rm {\mathrm{N}\mathrm{O}}_{2}} $ ,则该储存和还原技术也能减少尾气排放的 $ {\rm \mathrm{N}\mathrm{O}} $ , $ {\rm \mathrm{B}} $ 正确; $ 0~12.5\mathrm{s} $ 内,氢气的消耗速率 $ {\rm v({\mathrm{H}}_{2})=\dfrac{2000×{10}^{-6}\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}}{12.5\mathrm{s}}=1.6×{10}^{-4}\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}\cdot {\mathrm{s}}^{-1}} $ , $ {\rm \mathrm{C}} $ 正确;分析题图可知反应②分两步进行,第一个阶段硝酸钡和氢气反应生成氨气,有 $ {\rm \mathrm{B}\mathrm{a}({\mathrm{N}\mathrm{O}}_{3})_{2}\sim 2{\mathrm{N}\mathrm{H}}_{3}} $ ,第二个阶段硝酸钡和氨气反应生成氮气,根据得失电子守恒原则,有 $ {\rm 3\mathrm{B}\mathrm{a}({\mathrm{N}\mathrm{O}}_{3})_{2}\sim 10{\mathrm{N}\mathrm{H}}_{3}} $ ,两个阶段所用时间大致相同,生成或消耗 $ 1\mathrm{m}\mathrm{o}\mathrm{l} $ 氨气,第一步会消耗 $ 0.5\mathrm{m}\mathrm{o}\mathrm{l} $ 硝酸钡,第二步消耗 $ 0.3\mathrm{m}\mathrm{o}\mathrm{l} $ 硝酸钡,因此第二步 $ {\rm \mathrm{B}\mathrm{a}({\mathrm{N}\mathrm{O}}_{3})_{2}} $ 的消耗速率小于第一步的, $ {\rm \mathrm{D}} $ 错误。




