1.一定条件下,对于可逆反应 $ {\rm \mathrm{X}(\mathrm{g})+3\mathrm{Y}(\mathrm{g})⇌2\mathrm{Z}(\mathrm{g})} $ ,若 $ {\rm \mathrm{X}} $ 、 $ {\rm \mathrm{Y}} $ 、 $ {\rm \mathrm{Z}} $ 的起始浓度分别为 $ {c}_{1} $ 、 $ {c}_{2} $ 、 $ {c}_{3} $ (均不为零)。达到平衡时, $ {\rm \mathrm{X}} $ 、 $ {\rm \mathrm{Y}} $ 、 $ {\rm \mathrm{Z}} $ 的浓度分别为 $ {\rm 0.1\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}} $ 、 $ {\rm 0.3\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}} $ 和 $ {\rm 0.08\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}} $ ,则下列判断合理的是( )
$ ①{c}_{1}:{c}_{2}=1:3 $
②平衡时, $ {\rm \mathrm{Y}} $ 和 $ {\rm \mathrm{Z}} $ 的生成速率之比为 $ 2:3 $
$ {\rm ③\mathrm{X}} $ 和 $ {\rm \mathrm{Y}} $ 转化量之比为 $ 1:1 $
$ ④{c}_{2} $ 的取值范围为 $ {\rm 0 < {c}_{2} < 0.42\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}} $
A. ①②
B. ①④
C. ②③
D. ③④
答案:B
解析:平衡时 $ {\rm \mathrm{X}} $ 、 $ {\rm \mathrm{Y}} $ 的浓度之比为 $ 1:3 $ ,转化浓度之比也为 $ 1:3 $ ,故起始浓度 $ {c}_{1}:{c}_{2}=1:3 $ ,①正确; $ {\rm \mathrm{Y}} $ 的生成速率表示逆反应速率, $ {\rm \mathrm{Z}} $ 的生成速率表示正反应速率,则平衡时 $ {\rm {v}_{生成}(\mathrm{Y}):{v}_{生成}(\mathrm{Z})} $ 为 $ 3:2 $ ,②错误;反应中 $ {\rm \mathrm{X}} $ 和 $ {\rm \mathrm{Y}} $ 必然以物质的量之比为 $ 1:3 $ 消耗, $ {\rm \mathrm{X}} $ 和 $ {\rm \mathrm{Y}} $ 转化量之比为 $ 1:3 $ ,③错误;运用假设法,假设起始时 $ {\rm \mathrm{Z}} $ 的浓度为0,则 $ {c}_{2} $ 为 $ {\rm 0.42\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}} $ ,即 $ {c}_{2} $ 的取值范围为 $ {\rm 0 < {c}_{2} < 0.42\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}} $ ,④正确;故选 $ {\rm \mathrm{B}} $ 。
2.某化学兴趣小组模拟国际空间站处理二氧化碳的过程,主反应Ⅰ $ {\rm . {\mathrm{C}\mathrm{O}}_{2}(\mathrm{g})+4{\mathrm{H}}_{2}(\mathrm{g})⇌{\mathrm{C}\mathrm{H}}_{4}(\mathrm{g})+2{\mathrm{H}}_{2}\mathrm{O}(\mathrm{g})} $ ,副反应Ⅱ $ {\rm . {\mathrm{C}\mathrm{O}}_{2}(\mathrm{g})+{\mathrm{H}}_{2}(\mathrm{g})⇌\mathrm{C}\mathrm{O}(\mathrm{g})+{\mathrm{H}}_{2}\mathrm{O}(\mathrm{g})} $ 。在一定温度下该小组同学将 $ {\rm 1\mathrm{m}\mathrm{o}\mathrm{l}{\mathrm{C}\mathrm{O}}_{2}} $ 和 $ {\rm 4\mathrm{m}\mathrm{o}\mathrm{l}{\mathrm{H}}_{2}} $ 充入容积为 $ {\rm 1\mathrm{L}} $ 、装有催化剂的刚性容器中,反应达到平衡时,容器中的 $ {\rm {\mathrm{C}\mathrm{O}}_{2}} $ 转化率为 $ 90\% $ , $ {\rm {\mathrm{H}}_{2}} $ 转化率为 $ 82.5\% $ ,下列说法错误的是( )
A. 平衡体系中 $ {\rm {\mathrm{C}\mathrm{O}}_{2}} $ 和 $ {\rm \mathrm{C}\mathrm{O}} $ 的物质的量之比为 $ 1:1 $
B. 达到平衡时,体系中转移 $ 6.4\mathrm{m}\mathrm{o}\mathrm{l} $ 电子
C. 平衡体系中气态水的体积分数为 $ 50\% $
D. 反应前后容器内的密度保持不变,为 $ {\rm 52\mathrm{g}\cdot {\mathrm{L}}^{-1}} $
答案:B
解析:平衡时 $ {\rm {\mathrm{C}\mathrm{O}}_{2}} $ 为 $ 0.1\mathrm{m}\mathrm{o}\mathrm{l} $ , $ {\rm \mathrm{C}\mathrm{O}} $ 为 $ 0.1\mathrm{m}\mathrm{o}\mathrm{l} $ ,两者物质的量之比为 $ 1:1 $ , $ {\rm \mathrm{A}} $ 正确;主反应Ⅰ中 $ {\rm 0.8\mathrm{m}\mathrm{o}\mathrm{l}{\mathrm{C}\mathrm{O}}_{2}} $ 转移 $ 6.4\mathrm{m}\mathrm{o}\mathrm{l} $ 电子( $ {\rm \mathrm{C}} $ 的化合价由 $ +4 $ 价变为 $ -4 $ 价),副反应Ⅱ中 $ {\rm 0.1\mathrm{m}\mathrm{o}\mathrm{l}{\mathrm{C}\mathrm{O}}_{2}} $ 转移 $ 0.2\mathrm{m}\mathrm{o}\mathrm{l} $ 电子( $ {\rm \mathrm{C}} $ 的化合价由 $ +4 $ 价变为 $ +2 $ 价),转移 $ 6.6\mathrm{m}\mathrm{o}\mathrm{l} $ 电子, $ {\rm \mathrm{B}} $ 错误;平衡时气体总物质的量为 $ 3.4\mathrm{m}\mathrm{o}\mathrm{l} $ , $ {\rm n({\mathrm{H}}_{2}\mathrm{O})=1.7\mathrm{m}\mathrm{o}\mathrm{l}} $ ,体积分数为 $ 50\% $ , $ {\rm \mathrm{C}} $ 正确; $ {\rm 1\mathrm{m}\mathrm{o}\mathrm{l}{\mathrm{C}\mathrm{O}}_{2}} $ 和 $ {\rm 4\mathrm{m}\mathrm{o}\mathrm{l}{\mathrm{H}}_{2}} $ 的总质量为 $ 52\mathrm{g} $ ,反应前后气体总质量不变,容器容积固定为 $ {\rm 1\mathrm{L}} $ ,密度保持 $ {\rm 52\mathrm{g}\cdot {\mathrm{L}}^{-1}} $ , $ {\rm \mathrm{D}} $ 正确。
3.在相同条件下研究催化剂Ⅰ、Ⅱ对反应 $ {\rm \mathrm{X}\to 2\mathrm{Y}} $ 的影响,各物质浓度 $ c $ 随反应时间 $ t $ 的部分变化曲线如图,则下列说法正确的是( )
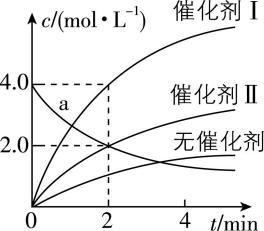
A. 无催化剂时,反应不能进行
B. 与催化剂Ⅰ相比,Ⅱ的催化效果更好
C. $ \mathrm{a} $ 曲线表示使用催化剂Ⅱ时 $ {\rm \mathrm{X}} $ 的浓度随 $ t $ 的变化
D. 使用催化剂Ⅰ时, $ 0\sim 2 \min $ 内, $ {\rm v(\mathrm{X})=1.0\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}\cdot { \min }^{-1}} $
答案:D
解析:由图可知,无催化剂时,随反应进行,生成物浓度在增加,说明反应也在进行, $ {\rm \mathrm{A}} $ 错误;由图可知,相同时间内,催化剂Ⅰ作用下生成物浓度增大更多,说明催化剂Ⅰ使反应活化能更低,反应更快,催化剂Ⅰ比催化剂Ⅱ催化效果好, $ {\rm \mathrm{B}} $ 错误;由图可知,使用催化剂Ⅱ时,在 $ 0\sim 2 \min $ 内 $ {\rm \mathrm{\Delta }c(\mathrm{Y})=2.0\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}} $ ,而 $ \mathrm{a} $ 曲线表示的 $ {\rm \mathrm{X}} $ 的浓度变化量也为 $ {\rm 2.0\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}} $ ,二者变化量之比不等于化学计量数之比,所以 $ \mathrm{a} $ 曲线不表示使用催化剂Ⅱ时 $ {\rm \mathrm{X}} $ 的浓度随时间 $ t $ 的变化, $ {\rm \mathrm{C}} $ 错误;使用催化剂Ⅰ时,在 $ 0\sim 2 \min $ 内, $ {\rm \mathrm{Y}} $ 的浓度变化了 $ {\rm 4.0\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}} $ ,则 $ {\rm v(\mathrm{X})=\dfrac{1}{2}v(\mathrm{Y})=\dfrac{1}{2}×\dfrac{4.0}{2}\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}\cdot { \min }^{-1}=1.0\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}\cdot { \min }^{-1}} $ , $ {\rm \mathrm{D}} $ 正确。
4.某同学用图甲所示装置及器材,测定碳酸钙与一定体积的盐酸反应生成 $ {\rm {\mathrm{C}\mathrm{O}}_{2}} $ 的体积 $ {\rm [V({\mathrm{C}\mathrm{O}}_{2})]} $ 随反应时间的变化情况,并绘制出图乙所示曲线。有关分析不正确的是( )
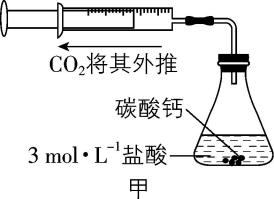
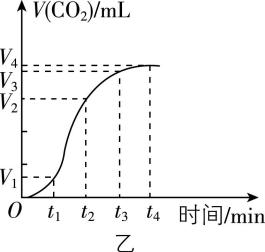
A. 收集气体最多的时间段为 $ {t}_{1}~{t}_{2} \min $
B. 将 $ {\rm {\mathrm{C}\mathrm{a}\mathrm{C}\mathrm{O}}_{3}} $ 粉碎可以加快反应速率
C. 平均反应速率: $ v({t}_{2}~{t}_{3} \min ) > v({t}_{1}~{t}_{2} \min ) > v(0~{t}_{1} \min ) > v({t}_{3}~{t}_{4} \min ) $
D. $ {\rm {\mathrm{C}\mathrm{a}\mathrm{C}\mathrm{O}}_{3}} $ 与盐酸反应的离子方程式为 $ {\rm {\mathrm{C}\mathrm{a}\mathrm{C}\mathrm{O}}_{3}+2{\mathrm{H}}^{+}\xlongequal{}{\mathrm{C}\mathrm{a}}^{2+}+{\mathrm{C}\mathrm{O}}_{2}↑+{\mathrm{H}}_{2}\mathrm{O}} $
答案:C
解析:根据题图可知, $ {t}_{1}~{t}_{2} \min $ 内收集气体的体积为 $ {\rm ({V}_{2}-{V}_{1})\mathrm{m}\mathrm{L}} $ ,该时间段收集气体的体积最大, $ {\rm \mathrm{A}} $ 正确;将 $ {\rm {\mathrm{C}\mathrm{a}\mathrm{C}\mathrm{O}}_{3}} $ 粉碎,增大其与盐酸的接触面积,反应速率加快, $ {\rm \mathrm{B}} $ 正确;根据相同时间内收集气体的体积大小,可知平均反应速率: $ v({t}_{1}~{t}_{2} \min ) > v({t}_{2}~{t}_{3} \min ) > v(0~{t}_{1} \min ) > v({t}_{3}~{t}_{4} \min ) $ , $ {\rm \mathrm{C}} $ 错误; $ {\rm {\mathrm{C}\mathrm{a}\mathrm{C}\mathrm{O}}_{3}} $ 与盐酸反应生成氯化钙、二氧化碳和水,反应的离子方程式为 $ {\rm {\mathrm{C}\mathrm{a}\mathrm{C}\mathrm{O}}_{3}+2{\mathrm{H}}^{+}\xlongequal{}{\mathrm{C}\mathrm{a}}^{2+}+{\mathrm{C}\mathrm{O}}_{2}↑+{\mathrm{H}}_{2}\mathrm{O}} $ , $ {\rm \mathrm{D}} $ 正确。
5.室温下,用 $ {\rm 0.1\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}{\mathrm{N}\mathrm{a}}_{2}{\mathrm{S}}_{2}{\mathrm{O}}_{3}} $ 溶液、 $ {\rm 0.1\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}{\mathrm{H}}_{2}{\mathrm{S}\mathrm{O}}_{4}} $ 溶液和蒸馏水进行如图表所示的5个实验,分别测量浑浊度随时间的变化(已知: $ {\rm {\mathrm{N}\mathrm{a}}_{2}{\mathrm{S}}_{2}{\mathrm{O}}_{3}+{\mathrm{H}}_{2}{\mathrm{S}\mathrm{O}}_{4}\xlongequal{}{\mathrm{N}\mathrm{a}}_{2}{\mathrm{S}\mathrm{O}}_{4}+\mathrm{S}↓+{\mathrm{S}\mathrm{O}}_{2}↑+{\mathrm{H}}_{2}\mathrm{O}} $ )。下列说法不正确的是( )
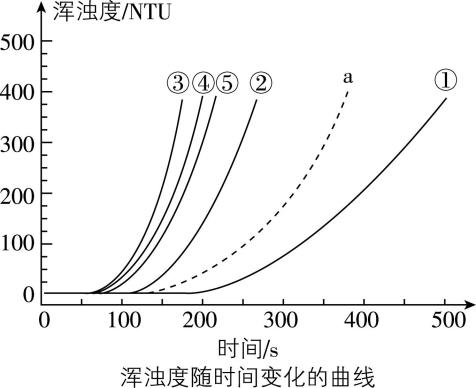
编号 | $ {\rm {\mathrm{N}\mathrm{a}}_{2}{\mathrm{S}}_{2}{\mathrm{O}}_{3}} $ 溶液 | $ {\rm {\mathrm{H}}_{2}{\mathrm{S}\mathrm{O}}_{4}} $ 溶液 | 蒸馏水 |
$ {\rm V/\mathrm{m}\mathrm{L}} $ | $ {\rm V/\mathrm{m}\mathrm{L}} $ | $ {\rm V/\mathrm{m}\mathrm{L}} $ |
① | 1.5 | 3.5 | 10 |
② | 2.5 | 3.5 | 9 |
③ | 3.5 | 3.5 | $ x $ |
④ | 3.5 | 2.5 | 9 |
⑤ | 3.5 | 1.5 | 10 |
A. 在加热条件下进行实验①,其浑浊度曲线应变为 $ \mathrm{a} $
B. 实验③中 $ x=8 $
C. 降低 $ {\rm {\mathrm{N}\mathrm{a}}_{2}{\mathrm{S}}_{2}{\mathrm{O}}_{3}} $ 溶液浓度和降低 $ {\rm {\mathrm{H}}_{2}{\mathrm{S}\mathrm{O}}_{4}} $ 溶液浓度对该反应化学反应速率影响程度相同
D. 实验①②③或③④⑤均可说明其他条件相同时,增大反应物浓度可增大该反应速率
答案:C
解析:题给反应有 $ {\rm \mathrm{S}} $ 单质生成,故随反应进行,生成的 $ {\rm \mathrm{S}} $ 越多,溶液浑浊度越大。加热,反应速率增大,在加热条件下进行实验①,可缩短到达相同浑浊度所需的时间,则浑浊度曲线应在曲线①左边,其浑浊度曲线应变为 $ \mathrm{a} $ , $ {\rm \mathrm{A}} $ 不符合题意;③④⑤变量为 $ {\rm {\mathrm{H}}_{2}{\mathrm{S}\mathrm{O}}_{4}} $ 的浓度,根据变量控制法的要求有 $ 3.5+2.5+9=3.5+3.5+x $ ,则实验③中 $ x=8 $ , $ {\rm \mathrm{B}} $ 不符合题意;实验①②③变量为硫代硫酸钠溶液的浓度,实验③④⑤变量为硫酸的浓度,由题图可知,达到相同浑浊度所需的时间: $ ③ < ④ < ⑤ < ② < ① $ ,可说明其他条件相同时,增大或降低硫代硫酸钠溶液的浓度和硫酸的浓度,对该反应化学反应速率影响程度不同, $ {\rm \mathrm{C}} $ 符合题意;实验①②③或③④⑤均可说明其他条件相同时,增大反应物浓度,可缩短达到相同浑浊度所需的时间,即可增大该反应速率, $ {\rm \mathrm{D}} $ 不符合题意。
6.速率和平衡是认识和研究化学反应的重要视角,回答下列问题:
(1) 温度为 $ {\rm T} $ 时,在A(容积为 $ {\rm 4\mathrm{L}} $ )、B(容积为 $ {\rm 2\mathrm{L}} $ )两刚性容器中分别充入 $ {\rm 2\mathrm{m}\mathrm{o}\mathrm{l}{\mathrm{C}\mathrm{O}}_{2}} $ 和 $ {\rm 6\mathrm{m}\mathrm{o}\mathrm{l}{\mathrm{H}}_{2}} $ ,催化剂作用下合成甲醇 $ {\rm ({\mathrm{C}\mathrm{H}}_{3}\mathrm{O}\mathrm{H})} $ 。容器内总压强 $ p $ 随时间变化如图甲所示。反应方程式为 $ {\rm {\mathrm{C}\mathrm{O}}_{2}(\mathrm{g})+3{\mathrm{H}}_{2}(\mathrm{g})⇌{\mathrm{C}\mathrm{H}}_{3}\mathrm{O}\mathrm{H}(\mathrm{g})+{\mathrm{H}}_{2}\mathrm{O}(\mathrm{g})} $ 。
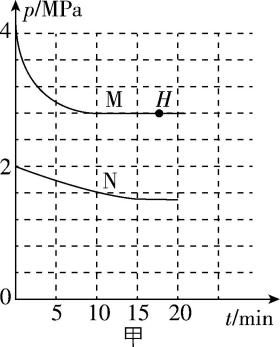
① 其中曲线 $ {\rm \mathrm{N}} $ 对应 (填“A”或“B”)容器中压强的变化情况。
② 曲线 $ {\rm \mathrm{M}} $ 中 $ 0\sim 10 \min $ 内 $ {\rm {\mathrm{H}}_{2}} $ 反应速率 $ {\rm v({\mathrm{H}}_{2})=} $ $ {\rm \mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}\cdot { \min }^{-1}} $ , $ {\rm H} $ 点对应的速率关系是 $ {\rm {v}_{正}({\mathrm{C}\mathrm{O}}_{2})} $ (填“ $ > $ ”“ $ < $ ”或“ $ = $ ”) $ {\rm {v}_{逆}({\mathrm{H}}_{2})} $ 。
③ 其他条件不变,只改变下列一个条件,能提高 $ {\rm {\mathrm{C}\mathrm{H}}_{3}\mathrm{O}\mathrm{H}(\mathrm{g})} $ 生成速率的是 (填序号)。
$ \mathrm{a} $ .降低温度
$ \mathrm{b} $ .充入 $ {\rm {\mathrm{H}}_{2}} $
$ \mathrm{c} $ .充入 $ {\rm {\mathrm{N}}_{2}} $
$ \mathrm{d} $ .及时移走部分 $ {\rm {\mathrm{H}}_{2}} $
④ 若恒温恒容时, $ {\rm {\mathrm{C}\mathrm{O}}_{2}} $ 和 $ {\rm {\mathrm{H}}_{2}} $ 投料比为 $ 1:1 $ ,下列示意图正确且能说明反应进行到 $ {t}_{1} $ 时刻达到平衡状态的是 (填序号)。
A. 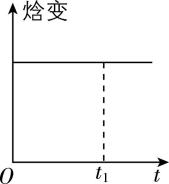 B.
B. 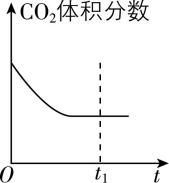
C. 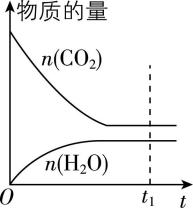 D.
D. 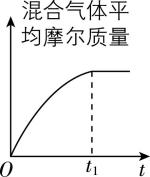
(2) 反应 $ {\rm 2\mathrm{N}\mathrm{O}(\mathrm{g})+{\mathrm{O}}_{2}(\mathrm{g})⇌{\mathrm{N}}_{2}{\mathrm{O}}_{4}(\mathrm{g})} $ 经历两步:
$ {\rm ⅰ.2\mathrm{N}\mathrm{O}(\mathrm{g})+{\mathrm{O}}_{2}(\mathrm{g})\xlongequal{}2{\mathrm{N}\mathrm{O}}_{2}(\mathrm{g})} $
$ {\rm ⅱ.2{\mathrm{N}\mathrm{O}}_{2}(\mathrm{g})⇌{\mathrm{N}}_{2}{\mathrm{O}}_{4}(\mathrm{g})} $
一定条件下,向恒容密闭容器中通入适量的 $ {\rm \mathrm{N}\mathrm{O}} $ 和 $ {\rm {\mathrm{O}}_{2}} $ ,反应体系中 $ {\rm c({\mathrm{N}\mathrm{O}}_{2})} $ 、 $ {\rm c(\mathrm{N}\mathrm{O})} $ 、 $ {\rm c({\mathrm{N}}_{2}{\mathrm{O}}_{4})} $ 随时间的变化曲线如图乙所示。
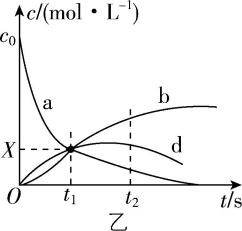
① 图乙中曲线 $ \mathrm{b} $ 代表 的浓度随时间的变化。
② $ {t}_{2}\mathrm{s} $ 时, $ {\rm c({\mathrm{N}\mathrm{O}}_{2})} $ 的生成速率 (填“大于”“小于”或“等于”)消耗速率。
③ $ {\rm X=} $ (用 $ {c}_{0} $ 表示)。
答案:① A
② 0.18; $ < $
③ $ \mathrm{b} $
④ D
(2) ① $ {\rm {\mathrm{N}}_{2}{\mathrm{O}}_{4}} $
② 小于
③ $ 0.25{c}_{0} $
解析:① 起始投料量相同的条件下,容器容积与压强成反比,起始压强大的体系对应容器的容积小,由图甲可知,曲线 $ {\rm \mathrm{N}} $ 对应容器 $ {\rm \mathrm{A}} $ ,曲线 $ {\rm \mathrm{M}} $ 对应容器 $ {\rm \mathrm{B}} $ 。
② 曲线 $ {\rm \mathrm{M}} $ 对应容器 $ {\rm \mathrm{B}} $ (容积为 $ {\rm 2\mathrm{L}} $ ),刚性容器中充入 $ {\rm 2\mathrm{m}\mathrm{o}\mathrm{l}{\mathrm{C}\mathrm{O}}_{2}} $ 和 $ {\rm 6\mathrm{m}\mathrm{o}\mathrm{l}{\mathrm{H}}_{2}} $ ,在适宜的催化剂作用下发生反应, $ 10 \min $ 时,反应达到平衡,总压强为 $ {\rm 2.8\mathrm{M}\mathrm{P}\mathrm{a}} $ ,设转化了 $ {\rm x\mathrm{m}\mathrm{o}\mathrm{l}{\mathrm{C}\mathrm{O}}_{2}} $ ,列出三段式:
$ {\rm\hspace{-0.5em} \begin{array} {l} \rm\hspace{-0.5em} \begin{array}{cccccccc}& {\mathrm{C}\mathrm{O}}_{2}\left(\mathrm{g}\right)& +& 3{\mathrm{H}}_{2}\left(\mathrm{g}\right)& ⇌& {\mathrm{C}\mathrm{H}}_{3}\mathrm{O}\mathrm{H}\left(\mathrm{g}\right)& +& {\mathrm{H}}_{2}\mathrm{O}\left(\mathrm{g}\right)\\ 起始量/\mathrm{m}\mathrm{o}\mathrm{l}& 2& & 6& & 0& & 0\\ 转化量/\mathrm{m}\mathrm{o}\mathrm{l}& x& & 3x& & x& & x\\ 平衡量/\mathrm{m}\mathrm{o}\mathrm{l}& 2-x& & 6-3x& & x& & x\end{array} \hspace{-0.5em}\end{array} \hspace{-0.5em} } $
恒温恒容条件下,压强之比等于物质的量之比,则 $ {\rm \dfrac{8\mathrm{m}\mathrm{o}\mathrm{l}}{(8-2x)\mathrm{m}\mathrm{o}\mathrm{l}}=\dfrac{4\mathrm{M}\mathrm{P}\mathrm{a}}{2.8\mathrm{M}\mathrm{P}\mathrm{a}}} $ ,解得 $ x=1.2 $ , $ 0\sim 10 \min $ 内, $ {\rm {\mathrm{H}}_{2}} $ 转化了 $ 3.6\mathrm{m}\mathrm{o}\mathrm{l} $ , $ {\rm v({\mathrm{H}}_{2})=\dfrac{\mathrm{\Delta }c}{\mathrm{\Delta }t}=\dfrac{\dfrac{3.6\mathrm{m}\mathrm{o}\mathrm{l}}{2\mathrm{L}}}{10 \min }=0.18\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}\cdot { \min }^{-1}} $ 。 $ {\rm H} $ 点反应已达到平衡,对应的速率关系是 $ {\rm {v}_{正}({\mathrm{C}\mathrm{O}}_{2})={v}_{逆}({\mathrm{C}\mathrm{O}}_{2})=\dfrac{1}{3}{v}_{逆}({\mathrm{H}}_{2})} $ , $ {\rm {v}_{正}({\mathrm{C}\mathrm{O}}_{2}) < {v}_{逆}({\mathrm{H}}_{2})} $ 。
③ 降低温度,化学反应速率降低, $ \mathrm{a} $ 错误;充入 $ {\rm {\mathrm{H}}_{2}} $ ,反应物浓度增加,化学反应速率加快, $ \mathrm{b} $ 正确;充入 $ {\rm {\mathrm{N}}_{2}} $ , $ {\rm {\mathrm{N}}_{2}} $ 不参与反应,不影响反应速率, $ \mathrm{c} $ 错误;及时移走部分 $ {\rm {\mathrm{H}}_{2}} $ ,反应物浓度降低,化学反应速率降低, $ \mathrm{d} $ 错误。
④ 温度一定时,焓变为定值,不能确定平衡状态, $ {\rm \mathrm{A}} $ 错误;设起始投入 $ {\rm n({\mathrm{C}\mathrm{O}}_{2})=n({\mathrm{H}}_{2})=1\mathrm{m}\mathrm{o}\mathrm{l}} $ ,某时刻转化了 $ {\rm y\mathrm{m}\mathrm{o}\mathrm{l}{\mathrm{C}\mathrm{O}}_{2}} $ ,列出三段式:
$ {\rm\hspace{-0.5em} \begin{array} {l} \rm\hspace{-0.5em} \begin{array}{cccccccc}& {\mathrm{C}\mathrm{O}}_{2}\left(\mathrm{g}\right)& +& 3{\mathrm{H}}_{2}\left(\mathrm{g}\right)& ⇌& {\mathrm{C}\mathrm{H}}_{3}\mathrm{O}\mathrm{H}\left(\mathrm{g}\right)& +& {\mathrm{H}}_{2}\mathrm{O}\left(\mathrm{g}\right)\\ {起始量}/\mathrm{m}\mathrm{o}\mathrm{l}& 1& & 1& & 0& & 0\\ {转化量}/\mathrm{m}\mathrm{o}\mathrm{l}& y& & 3y& & y& & y\\ {某时刻量}/\mathrm{m}\mathrm{o}\mathrm{l}& 1-y& & 1-3y& & y& & y\end{array} \hspace{-0.5em}\end{array} \hspace{-0.5em} } $
则任一时刻 $ {\rm {\mathrm{C}\mathrm{O}}_{2}} $ 体积分数为 $ \dfrac{1-y}{2-2y}=0.5 $ ,是定值,随反应进行不发生变化, $ {\rm \mathrm{B}} $ 错误;根据反应方程式,消耗的 $ {\rm {\mathrm{C}\mathrm{O}}_{2}} $ 的物质的量与生成的 $ {\rm {\mathrm{H}}_{2}\mathrm{O}} $ 的物质的量相等, $ {\rm \mathrm{C}} $ 项中二氧化碳、水的变化量与反应不符, $ {\rm \mathrm{C}} $ 错误;正反应为气体物质的量减少的反应,且气体质量不变,则随反应进行,平均摩尔质量逐渐增大,平均摩尔质量不变时反应达到平衡状态, $ {\rm \mathrm{D}} $ 正确。
(2) ① $ {\rm \mathrm{N}\mathrm{O}} $ 为反应物,随反应进行, $ {\rm \mathrm{N}\mathrm{O}} $ 浓度一直减小,曲线 $ \mathrm{a} $ 代表 $ {\rm \mathrm{N}\mathrm{O}} $ ; $ {\rm {\mathrm{N}\mathrm{O}}_{2}} $ 为中间产物,浓度先增大后减小,曲线 $ \mathrm{d} $ 代表 $ {\rm {\mathrm{N}\mathrm{O}}_{2}} $ ; $ {\rm {\mathrm{N}}_{2}{\mathrm{O}}_{4}} $ 为产物,浓度一直增大,曲线 $ \mathrm{b} $ 代表 $ {\rm {\mathrm{N}}_{2}{\mathrm{O}}_{4}} $ 。
② $ {t}_{2}\mathrm{s} $ 时, $ {\rm c({\mathrm{N}\mathrm{O}}_{2})} $ 减小,说明其生成速率小于消耗速率。
③ $ {t}_{1}\mathrm{s} $ 时, $ {\rm c({\mathrm{N}\mathrm{O}}_{2})=c(\mathrm{N}\mathrm{O})=c({\mathrm{N}}_{2}{\mathrm{O}}_{4})} $ ,根据 $ {\rm \mathrm{N}} $ 元素守恒, $ {\rm c({\mathrm{N}\mathrm{O}}_{2})=0.25{c}_{0}\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}} $ ,即 $ {\rm X=0.25{c}_{0}} $ 。





 B.
B. 
 D.
D. 
