课时2 化学反应的限度
一、刷基础
1.观察图:对合成氨反应,下列叙述错误的是( )
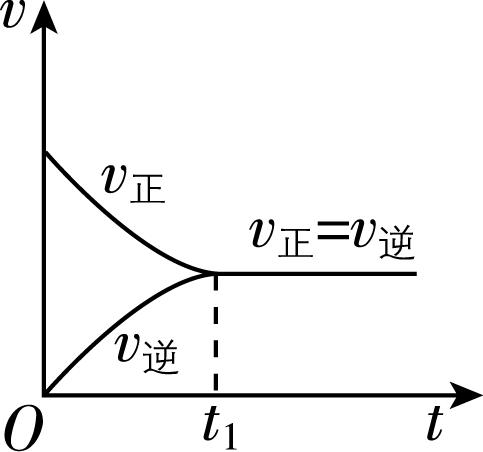
A. 开始反应时,正反应速率最大,逆反应速率为零
B. 随着反应的进行,正反应速率逐渐减小,逆反应速率逐渐增大
C. 反应到达 $ {t}_{1} $ 时,正反应速率与逆反应速率相等,反应停止
D. 反应在 $ {t}_{1} $ 之后,正反应速率与逆反应速率相等,反应达到化学平衡状态
答案:C
解析:反应开始时,反应物的浓度最大,正反应速率最大,生成物的浓度为零,逆反应速率为零, $ {\rm \mathrm{A}} $ 正确;随着反应的进行,反应物的浓度降低,则正反应速率逐渐减小,生成物的浓度增大,则逆反应速率逐渐增大, $ {\rm \mathrm{B}} $ 正确;反应到达 $ {t}_{1} $ 时,正反应速率与逆反应速率相等,但都不为零,反应没有停止, $ {\rm \mathrm{C}} $ 错误;反应在 $ {t}_{1} $ 之后,正反应速率与逆反应速率相等,反应达到化学平衡状态, $ {\rm \mathrm{D}} $ 正确。
2.下列过程与可逆反应无关的是( )
A. 高炉炼铁排放的尾气,随高炉的高度增加, $ {\rm \mathrm{C}\mathrm{O}} $ 的比例不变
B. 氯气溶于水,溶液中既存在 $ {\rm {\mathrm{C}\mathrm{l}}^{-}} $ 也存在 $ {\rm {\mathrm{C}\mathrm{l}}_{2}} $
C. 铜和浓硫酸在加热条件下能反应,不加热不能反应
D. $ {\rm {\mathrm{S}\mathrm{O}}_{2}} $ 和 $ {\rm {\mathrm{O}}_{2}} $ 在接触室中反应生成 $ {\rm {\mathrm{S}\mathrm{O}}_{3}} $
答案:C
解析:高炉炼铁的尾气中 $ {\rm \mathrm{C}\mathrm{O}} $ 比例不变说明反应 $ {\rm \mathrm{C}+{\mathrm{C}\mathrm{O}}_{2}⇌2\mathrm{C}\mathrm{O}} $ 是可逆反应, $ {\rm \mathrm{A}} $ 不符合题意; $ {\rm {\mathrm{C}\mathrm{l}}_{2}} $ 溶于水存在可逆反应: $ {\rm {\mathrm{C}\mathrm{l}}_{2}+{\mathrm{H}}_{2}\mathrm{O}⇌\mathrm{H}\mathrm{C}\mathrm{l}\mathrm{O}+{\mathrm{H}}^{+}+{\mathrm{C}\mathrm{l}}^{-}} $ ,溶液中既存在 $ {\rm {\mathrm{C}\mathrm{l}}^{-}} $ 也存在 $ {\rm {\mathrm{C}\mathrm{l}}_{2}} $ , $ {\rm \mathrm{B}} $ 不符合题意;铜与浓硫酸在加热时反应生成 $ {\rm {\mathrm{S}\mathrm{O}}_{2}} $ 等产物,常温下不反应,与可逆反应无关, $ {\rm \mathrm{C}} $ 符合题意; $ {\rm {\mathrm{S}\mathrm{O}}_{2}} $ 与 $ {\rm {\mathrm{O}}_{2}} $ 反应生成 $ {\rm {\mathrm{S}\mathrm{O}}_{3}} $ 是典型的可逆反应: $ {\rm 2{\mathrm{S}\mathrm{O}}_{2}+{\mathrm{O}}_{2}\stackrel{催化剂}{\underset{△}{⇌}}2{\mathrm{S}\mathrm{O}}_{3}} $ , $ {\rm \mathrm{D}} $ 不符合题意。
3.下列关于平衡状态和反应限度的说法正确的是( )
A. 一个可逆反应达到平衡状态后,这个反应在该条件下不再反应
B. 当一个可逆反应达到平衡状态时,正、逆反应速率相等
C. 平衡状态是一种静止的状态,反应物和生成物的浓度相等
D. 化学反应的限度不可以通过改变条件而改变
答案:B
解析:化学平衡是一个动态平衡,可逆反应在平衡状态时仍然继续进行反应,只不过正、逆反应速率相等, $ {\rm \mathrm{A}} $ 错误, $ {\rm \mathrm{B}} $ 正确;平衡状态是一种表面静止的状态,正、逆反应速率相等,各组分的浓度保持不变,但反应物和生成物的浓度不一定相等, $ {\rm \mathrm{C}} $ 错误;化学反应的限度可以通过改变条件而改变, $ {\rm \mathrm{D}} $ 错误。
4.在一定温度下,恒容的密闭容器中,可逆反应 $ {\rm \mathrm{X}(\mathrm{g})+3\mathrm{Y}(\mathrm{g})⇌2\mathrm{Z}(\mathrm{g})} $ 达到平衡的标志是( )
A. 气体总质量保持不变
B. $ {\rm \mathrm{X}} $ 、 $ {\rm \mathrm{Y}} $ 、 $ {\rm \mathrm{Z}} $ 的浓度都相等
C. 容器内压强不再发生变化
D. $ {\rm \mathrm{X}} $ 、 $ {\rm \mathrm{Y}} $ 、 $ {\rm \mathrm{Z}} $ 的分子数之比为 $ 1:3:2 $
答案:C
解析:反应前后全是气体,气体总质量是恒量,气体总质量保持不变,反应不一定平衡, $ {\rm \mathrm{A}} $ 不符合题意; $ {\rm \mathrm{X}} $ 、 $ {\rm \mathrm{Y}} $ 、 $ {\rm \mathrm{Z}} $ 的浓度都相等,不能判断浓度是否还发生改变,反应不一定平衡, $ {\rm \mathrm{B}} $ 不符合题意;该反应为反应前后气体分子数发生变化的反应,气体总物质的量是变量,压强是变量,容器内压强不再发生变化,反应一定达到平衡状态, $ {\rm \mathrm{C}} $ 符合题意; $ {\rm \mathrm{X}} $ 、 $ {\rm \mathrm{Y}} $ 、 $ {\rm \mathrm{Z}} $ 的分子数之比为 $ 1:3:2 $ ,不能判断各物质浓度是否还发生改变,反应不一定平衡, $ {\rm \mathrm{D}} $ 不符合题意。
5.可逆反应 $ {\rm 2{\mathrm{N}\mathrm{O}}_{2}(\mathrm{g})} $ (红棕色) $ {\rm ⇌2\mathrm{N}\mathrm{O}(\mathrm{g})} $ (无色) $ {\rm +{\mathrm{O}}_{2}(\mathrm{g})} $ ,在容积固定的密闭容器中达到平衡状态的标志是( )
①单位时间内生成 $ {\rm n\mathrm{m}\mathrm{o}\mathrm{l}{\mathrm{O}}_{2}} $ 的同时生成 $ {\rm 2n\mathrm{m}\mathrm{o}\mathrm{l}{\mathrm{N}\mathrm{O}}_{2}} $ ②单位时间内生成 $ {\rm n\mathrm{m}\mathrm{o}\mathrm{l}{\mathrm{O}}_{2}} $ 的同时生成 $ {\rm 2n\mathrm{m}\mathrm{o}\mathrm{l}\mathrm{N}\mathrm{O}} $ ③用 $ {\rm {\mathrm{N}\mathrm{O}}_{2}} $ 、 $ {\rm \mathrm{N}\mathrm{O}} $ 、 $ {\rm {\mathrm{O}}_{2}} $ 表示的反应速率之比为 $ 2:2:1 $ 的状态 ④混合气体的颜色不再改变的状态 ⑤混合气体的密度不再改变的状态 ⑥混合气体的压强不再改变的状态 ⑦混合气体的平均相对分子质量不再改变的状态
A. ①④⑥⑦
B. ②③⑤⑦
C. ①③④⑤
D. ①②③④⑤⑥⑦
答案:A
解析:①单位时间内生成 $ {\rm n\mathrm{m}\mathrm{o}\mathrm{l}{\mathrm{O}}_{2}} $ 的同时生成 $ {\rm 2n\mathrm{m}\mathrm{o}\mathrm{l}{\mathrm{N}\mathrm{O}}_{2}} $ ,正、逆反应速率相等,说明反应已达到平衡状态。②生成 $ {\rm {\mathrm{O}}_{2}} $ 和生成 $ {\rm \mathrm{N}\mathrm{O}} $ 都是正反应方向,单位时间内生成 $ {\rm n\mathrm{m}\mathrm{o}\mathrm{l}{\mathrm{O}}_{2}} $ 必生成 $ {\rm 2n\mathrm{m}\mathrm{o}\mathrm{l}\mathrm{N}\mathrm{O}} $ ,不能判断正、逆反应速率是否相等,不能说明反应达到平衡状态。③中无论达到平衡与否,用各物质表示的化学反应速率之比都等于化学计量数之比,所以 $ {\rm {\mathrm{N}\mathrm{O}}_{2}} $ 、 $ {\rm \mathrm{N}\mathrm{O}} $ 、 $ {\rm {\mathrm{O}}_{2}} $ 表示的反应速率之比为 $ 2:2:1 $ 的状态不一定是平衡状态。 $ {\rm ④{\mathrm{N}\mathrm{O}}_{2}} $ 为红棕色气体,其余为无色气体,混合气体的颜色不变,则表示 $ {\rm {\mathrm{N}\mathrm{O}}_{2}} $ 的浓度不再变化,说明反应已达到平衡状态。⑤容器容积固定、反应前后气体质量守恒,气体密度始终不变,混合气体的密度不再改变不一定是平衡状态。⑥反应后气体的物质的量增大,压强是变量,压强不变,意味着各物质的含量不再变化,说明已达到平衡状态。⑦由于气体的质量不变,反应后气体分子数增多,平均相对分子质量减小,气体的平均相对分子质量不变,说明气体中各物质的物质的量不变,反应已达到平衡状态。①④⑥⑦达到平衡状态,选 $ {\rm \mathrm{A}} $ 。
6.硫酸是一种重要的化工产品,目前硫酸的主要生产方法是“接触法”,其主要反应之一为 $ {\rm 2{\mathrm{S}\mathrm{O}}_{2}+{\mathrm{O}}_{2}\stackrel{催化剂}{\underset{△}{⇌}}2{\mathrm{S}\mathrm{O}}_{3}} $ 。下列有关该反应的说法不正确的是( )
A. $ {\rm {\mathrm{S}\mathrm{O}}_{2}} $ 和 $ {\rm {\mathrm{O}}_{2}} $ 不可能全部转化为 $ {\rm {\mathrm{S}\mathrm{O}}_{3}} $
B. 反应达到平衡后,正、逆反应速率相等且均为0
C. 该反应从开始到平衡的过程中,正反应速率不断减小,逆反应速率不断增大,某一时刻,正、逆反应速率相等
D. 工业上生产 $ {\rm {\mathrm{S}\mathrm{O}}_{3}} $ 时,要同时考虑反应所能达到的限度和化学反应速率两方面的问题
答案:B
解析:该反应为可逆反应,反应物的转化率 $ < 100\% $ ,故 $ {\rm {\mathrm{S}\mathrm{O}}_{2}} $ 和 $ {\rm {\mathrm{O}}_{2}} $ 不可能全部转化为 $ {\rm {\mathrm{S}\mathrm{O}}_{3}} $ , $ {\rm \mathrm{A}} $ 正确;反应达到平衡后,正、逆反应速率相等,化学平衡是一种动态平衡,反应速率不可能为 $ {\rm 0, \mathrm{B}} $ 错误;该反应从开始到平衡的过程中,反应物浓度不断减小,生成物浓度不断增大,故正反应速率不断减小,逆反应速率不断增大,某一时刻,正、逆反应速率相等,达到平衡状态, $ {\rm \mathrm{C}} $ 正确;工业上生产 $ {\rm {\mathrm{S}\mathrm{O}}_{3}} $ 时,要考虑转化率及反应时间,即同时考虑反应所能达到的限度和化学反应速率两方面的问题, $ {\rm \mathrm{D}} $ 正确。
7.对于可逆反应 $ {\rm 4{\mathrm{N}\mathrm{H}}_{3}+5{\mathrm{O}}_{2}⇌4\mathrm{N}\mathrm{O}+6{\mathrm{H}}_{2}\mathrm{O}} $ ,下列叙述正确的是( )
A. 加入催化剂,可以加快反应速率并增大反应限度
B. 保持容器内气体压强不变,向其中加入 $ {\rm \mathrm{H}\mathrm{e}} $ ,化学反应速率不变
C. 保持容器容积不变,向其中加入 $ {\rm \mathrm{H}\mathrm{e}} $ ,化学反应速率增大
D. 达到化学平衡时, $ {\rm 4{v}_{正}({\mathrm{O}}_{2})=5{v}_{逆}(\mathrm{N}\mathrm{O})} $
答案:D
解析:催化剂能加快反应速率,但不能改变反应限度, $ {\rm \mathrm{A}} $ 错误;恒压下,充入 $ {\rm \mathrm{H}\mathrm{e}} $ ,容器容积增大,反应物浓度降低,化学反应速率减小, $ {\rm \mathrm{B}} $ 错误;恒容下,充入 $ {\rm \mathrm{H}\mathrm{e}} $ ,反应物浓度不变,化学反应速率不变, $ {\rm \mathrm{C}} $ 错误;平衡时,正、逆反应速率之比等于化学计量数之比,则达到化学平衡时, $ {\rm 4{v}_{正}({\mathrm{O}}_{2})=5{v}_{逆}(\mathrm{N}\mathrm{O})} $ , $ {\rm \mathrm{D}} $ 正确。
