课时1 化学反应的速率
一、刷基础
1.下列说法正确的是( )
A. 化学反应速率通常用单位时间内反应物或生成物的质量变化来表示
B. 用不同物质的浓度变化表示同一段时间内、同一反应的速率时,其数值之比等于化学方程式中对应物质的化学计量数之比
C. 化学反应速率指的是某时刻的瞬时速率
D. 化学反应速率的单位由时间单位和物质的量单位决定
答案:B
解析:化学反应速率通常用单位时间内反应物浓度的减小或生成物浓度的增大来表示(取正值), $ {\rm \mathrm{A}} $ 错误;用不同物质的浓度变化表示同一段时间内、同一反应的速率时,其数值之比等于化学方程式中对应物质的化学计量数之比, $ {\rm \mathrm{B}} $ 正确;化学反应速率指的是某时间段内的平均速率, $ {\rm \mathrm{C}} $ 错误;化学反应速率的单位由时间单位和物质的量浓度单位决定, $ {\rm \mathrm{D}} $ 错误。
2.某温度下,在 $ {\rm 3\mathrm{L}} $ 恒容密闭容器中投入一定量的A、B,发生反应: $ {\rm 3\mathrm{A}(\mathrm{g})+b\mathrm{B}(\mathrm{g})⇌c\mathrm{C}(\mathrm{g})+2\mathrm{D}(\mathrm{s})} $ , $ 12\mathrm{s} $ 时生成C的物质的量为 $ 1.2\mathrm{m}\mathrm{o}\mathrm{l} $ (反应进程如图所示)。下列说法中正确的是( )
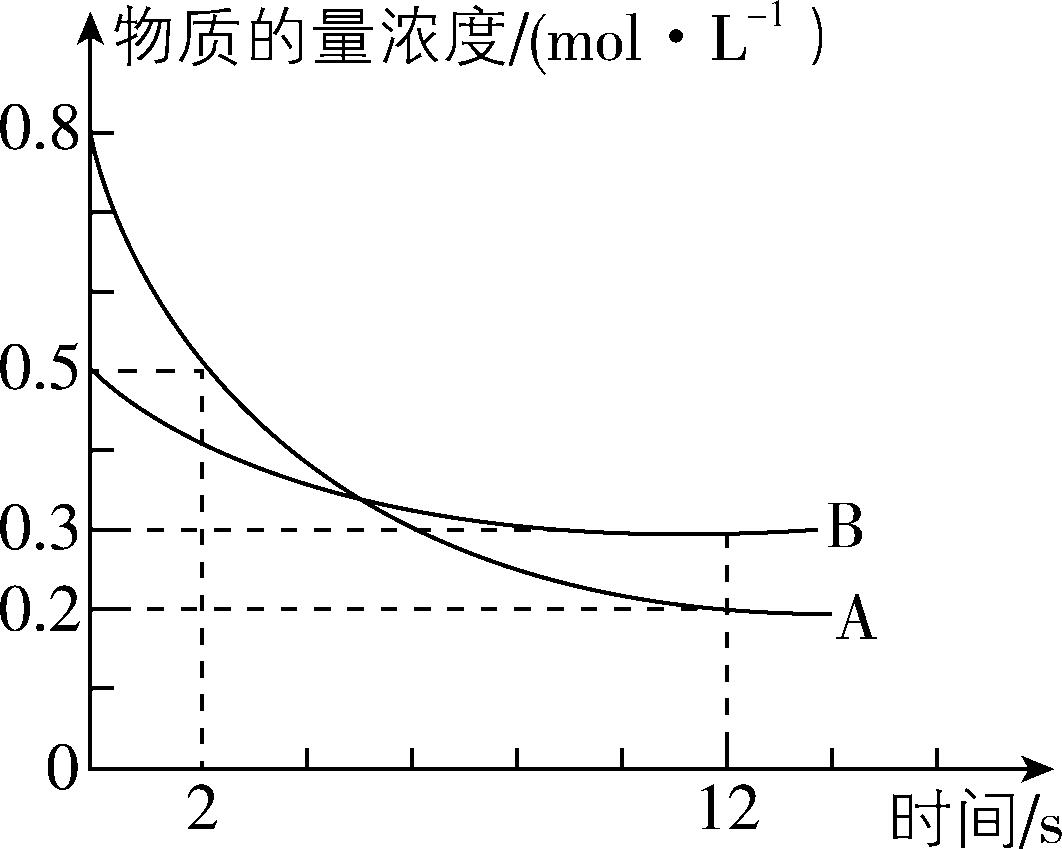
A. 图中两曲线相交时,A的消耗速率等于A的生成速率
B. 化学计量数之比 $ b:c=2:1 $
C. $ 12\mathrm{s} $ 时,B的转化率为 $ 40\% $
D. $ 0\sim 2\mathrm{s} {\rm ,D} $ 的平均反应速率为 $ {\rm 0.1\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}\cdot {\mathrm{s}}^{-1}} $
答案:C
解析:由图可知,两曲线相交后, $ {\rm \mathrm{A}} $ 的浓度还在降低, $ {\rm \mathrm{A}} $ 的消耗速率大于 $ {\rm \mathrm{A}} $ 的生成速率, $ {\rm \mathrm{A}} $ 错误;浓度变化量之比等于化学计量数之比, $ 12\mathrm{s} $ 内 $ {\rm \mathrm{A}} $ 、 $ {\rm \mathrm{B}} $ 、 $ {\rm \mathrm{C}} $ 的浓度变化分别为 $ {\rm 0.6\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}} $ 、 $ {\rm 0.2\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}} $ 、 $ {\rm \dfrac{1.2\mathrm{m}\mathrm{o}\mathrm{l}}{3\mathrm{L}}=0.4\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}} $ ,化学计量数之比 $ b:c=1:2 $ , $ {\rm \mathrm{B}} $ 错误; $ 12\mathrm{s} $ 内, $ {\rm \mathrm{B}} $ 的浓度由 $ {\rm 0.5\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}} $ 变为 $ {\rm 0.3\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}} $ , $ 12\mathrm{s} $ 时 $ {\rm \mathrm{B}} $ 的转化率为 $ {\rm \dfrac{(0.5-0.3)\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}}{0.5\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}}×100\%=40\%} $ , $ {\rm \mathrm{C}} $ 正确; $ {\rm \mathrm{D}} $ 是固体,不能用 $ {\rm \mathrm{D}} $ 的浓度变化表示反应速率, $ {\rm \mathrm{D}} $ 错误。
3.将 $ {\rm 2\mathrm{m}\mathrm{o}\mathrm{l}\mathrm{A}} $ 和 $ {\rm 4\mathrm{m}\mathrm{o}\mathrm{l}\mathrm{B}} $ 在 $ {\rm 2\mathrm{L}} $ 的恒容密闭容器中混合,一定条件下发生反应: $ {\rm \mathrm{A}(\mathrm{g})+n\mathrm{B}(\mathrm{g})⇌3\mathrm{C}(\mathrm{g})} $ , $ 5 \min $ 后测得A剩余 $ 0.8\mathrm{m}\mathrm{o}\mathrm{l} {\rm ,B} $ 的平均反应速率为 $ {\rm 0.24\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}\cdot { \min }^{-1}} $ ,则 $ n $ 为( )
A. 1
B. 2
C. 3
D. 4
答案:B
解析:根据题意可计算出 $ 5 \min $ 内 $ {\rm \mathrm{A}} $ 的平均反应速率 $ {\rm v(\mathrm{A})=\dfrac{(2-0.8)\mathrm{m}\mathrm{o}\mathrm{l}}{2\mathrm{L}×5 \min }=0.12\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}\cdot { \min }^{-1}} $ ,已知 $ 5 \min $ 内 $ {\rm \mathrm{B}} $ 的平均反应速率 $ {\rm v(\mathrm{B})=0.24\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}\cdot { \min }^{-1}} $ ,又因为同一反应、同一时间段内用不同物质表示的化学反应速率之比等于相应物质的化学计量数之比,即 $ {\rm \dfrac{v(\mathrm{A})}{v(\mathrm{B})}=\dfrac{1}{n}} $ ,所以 $ n=2 $ ,选 $ {\rm \mathrm{B}} $ 。
4.反应 $ {\rm 4\mathrm{A}(\mathrm{s})+5\mathrm{B}(\mathrm{g})⇌4\mathrm{C}(\mathrm{g})+6\mathrm{D}(\mathrm{g})} $ 在 $ {\rm 10\mathrm{L}} $ 密闭容器中进行,半分钟后,D的物质的量增加了 $ 0.45\mathrm{m}\mathrm{o}\mathrm{l} $ ,则下列说法正确的是( )
A. 半分钟时 $ {\rm v(\mathrm{B})=0.0015\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}\cdot {\mathrm{s}}^{-1}} $
B. 半分钟内 $ {\rm v(\mathrm{A})=0.0010\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}\cdot {\mathrm{s}}^{-1}} $
C. 半分钟内 $ {\rm v(\mathrm{C})=0.0010\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}\cdot {\mathrm{s}}^{-1}} $
D. 半分钟内 $ {\rm v(\mathrm{D})=0.045\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}\cdot {\mathrm{s}}^{-1}} $
答案:C
解析:化学反应速率是一段时间内的平均速率,不是瞬时速率,半分钟时的 $ {\rm v(\mathrm{B})} $ 是指瞬时速率,根据题给信息无法计算, $ {\rm \mathrm{A}} $ 错误; $ {\rm \mathrm{A}} $ 物质是固体,浓度视为常数,不能用其浓度变化表示反应速率, $ {\rm \mathrm{B}} $ 错误;半分钟后, $ {\rm \mathrm{D}} $ 的物质的量增加了 $ 0.45\mathrm{m}\mathrm{o}\mathrm{l} $ ,则半分钟内 $ {\rm v(\mathrm{D})=\dfrac{\mathrm{\Delta }n(\mathrm{D})}{V\mathrm{\Delta }t}=\dfrac{0.45\mathrm{m}\mathrm{o}\mathrm{l}}{10\mathrm{L}×30\mathrm{s}}=0.0015\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}\cdot {\mathrm{s}}^{-1}} $ , $ {\rm v(\mathrm{C})=\dfrac{4}{6}v(\mathrm{D})=0.0010\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}\cdot {\mathrm{s}}^{-1}} $ , $ {\rm \mathrm{C}} $ 正确、 $ {\rm \mathrm{D}} $ 错误。
5.关于 $ {\rm 2\mathrm{A}(\mathrm{g})+\mathrm{B}(\mathrm{g})⇌3\mathrm{C}(\mathrm{g})} $ 的化学反应,下列表示的反应速率最快的是( )
A. $ {\rm v(\mathrm{A})=0.5\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}\cdot { \min }^{-1}} $
B. $ {\rm v(\mathrm{B})=0.4\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}\cdot { \min }^{-1}} $
C. $ {\rm v(\mathrm{C})=0.01\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}\cdot {\mathrm{s}}^{-1}} $
D. $ {\rm v(\mathrm{C})=1.1\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}\cdot { \min }^{-1}} $
答案:B
解析:统一单位并换算成用物质 $ {\rm \mathrm{B}} $ 表示的反应速率,再比较数值大小。 $ {\rm \mathrm{A}} $ 项, $ {\rm v(\mathrm{B})=\dfrac{v(\mathrm{A})}{2}=\dfrac{0.5\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}\cdot { \min }^{-1}}{2}=0.25\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}\cdot { \min }^{-1}} $ ; $ {\rm \mathrm{B}} $ 项, $ {\rm v(\mathrm{B})=0.4\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}\cdot { \min }^{-1}} $ ; $ {\rm \mathrm{C}} $ 项, $ {\rm v(\mathrm{B})=\dfrac{v(\mathrm{C})}{3}=\dfrac{0.01\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}\cdot {\mathrm{s}}^{-1}}{3}=\dfrac{0.01\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}\cdot {\mathrm{s}}^{-1}}{3}×60\mathrm{s}\cdot { \min }^{-1}=0.2\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}\cdot { \min }^{-1}} $ ; $ {\rm \mathrm{D}} $ 项, $ {\rm v(\mathrm{B})=\dfrac{v(\mathrm{C})}{3}=\dfrac{1.1\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}\cdot { \min }^{-1}}{3}\approx 0.367\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}\cdot { \min }^{-1}} $ ,选 $ {\rm \mathrm{B}} $ 。
6.化学反应: $ {\rm \mathrm{A}(\mathrm{g})+3\mathrm{B}(\mathrm{g})\xlongequal{}\mathrm{C}(\mathrm{g})+2\mathrm{D}(\mathrm{g})} $ ,在4种不同情况下的化学反应速率分别为 $ {\rm ①v(\mathrm{A})=0.2\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}\cdot {\mathrm{s}}^{-1}} $ ; $ {\rm ②v(\mathrm{B})=0.45\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}\cdot {\mathrm{s}}^{-1}} $ ; $ {\rm ③v(\mathrm{C})=0.3\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}\cdot {\mathrm{s}}^{-1}} $ ; $ {\rm ④v(\mathrm{D})=0.45\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}\cdot {\mathrm{s}}^{-1}} $ 。下列有关化学反应速率的比较中正确的是( )
A. $ ① > ② > ③ > ④ $
B. $ ① < ③ < ②=④ $
C. $ ① > ②=③ > ④ $
D. $ ② < ① < ④ < ③ $
答案:D
解析:化学反应中,某物质表示的化学反应速率与该物质的化学计量数的比值越大,化学反应速率越大,由题中数据可知, $ {\rm \dfrac{v(\mathrm{C})}{1}(0.3\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}\cdot {\mathrm{s}}^{-1}) > \dfrac{v(\mathrm{D})}{2}(0.225\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}\cdot {\mathrm{s}}^{-1}) > \dfrac{v(\mathrm{A})}{1}(0.2\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}\cdot {\mathrm{s}}^{-1}) > \dfrac{v(\mathrm{B})}{3}(0.15\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}\cdot {\mathrm{s}}^{-1})} $ ,故化学反应速率: $ ② < ① < ④ < ③ $ ,选 $ {\rm \mathrm{D}} $ 。
7.下列措施对改变反应速率的影响正确的是( )
A. $ {\rm {\mathrm{C}\mathrm{a}\mathrm{C}\mathrm{O}}_{3}} $ 与稀盐酸反应,加入 $ {\rm \mathrm{N}\mathrm{a}\mathrm{C}\mathrm{l}} $ 溶液后不会改变反应速率
B. 在合成氨反应 $ {\rm {\mathrm{N}}_{2}(\mathrm{g})+3{\mathrm{H}}_{2}(\mathrm{g})⇌2{\mathrm{N}\mathrm{H}}_{3}(\mathrm{g})} $ 中,保持温度和容器容积不变,增加氮气的量能增大反应速率
C. 加入催化剂一定加快反应的速率
D. $ {\rm \mathrm{Z}\mathrm{n}} $ 与稀硫酸反应制取 $ {\rm {\mathrm{H}}_{2}} $ ,改用 $ 98\% $ 的浓硫酸将加快 $ {\rm {\mathrm{H}}_{2}} $ 的生成速率
答案:B
解析: $ {\rm {\mathrm{C}\mathrm{a}\mathrm{C}\mathrm{O}}_{3}} $ 与稀盐酸反应的实质是碳酸钙与氢离子反应,加入 $ {\rm \mathrm{N}\mathrm{a}\mathrm{C}\mathrm{l}} $ 溶液后,氢离子浓度减小,反应速率减慢, $ {\rm \mathrm{A}} $ 错误;保持温度和容器容积不变,增加氮气的量,则氮气的浓度增加,因此能增大反应速率, $ {\rm \mathrm{B}} $ 正确;存在可使反应速率减缓的催化剂, $ {\rm \mathrm{C}} $ 错误; $ 98\% $ 的浓硫酸具有强氧化性,与 $ {\rm \mathrm{Z}\mathrm{n}} $ 反应生成的是 $ {\rm {\mathrm{S}\mathrm{O}}_{2}} $ 而不是 $ {\rm {\mathrm{H}}_{2}} $ , $ {\rm \mathrm{D}} $ 错误。
8.反应 $ {\rm \mathrm{C}(\mathrm{s})+{\mathrm{H}}_{2}\mathrm{O}(\mathrm{g})⇌\mathrm{C}\mathrm{O}(\mathrm{g})+{\mathrm{H}}_{2}(\mathrm{g})} $ 在一容积可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
A. 降低温度
B. 将容器的容积缩小一半
C. 保持容积不变,充入 $ {\rm {\mathrm{N}}_{2}} $ 使体系压强增大
D. 保持压强不变,充入 $ {\rm {\mathrm{N}}_{2}} $ 使容器容积变大
答案:C
解析:降低温度,反应速率减小, $ {\rm \mathrm{A}} $ 错误;将容器的容积缩小一半,反应物浓度变大,反应速率增大, $ {\rm \mathrm{B}} $ 错误;保持容积不变,充入 $ {\rm {\mathrm{N}}_{2}} $ 使体系压强增大,反应物的浓度不变,对反应速率几乎没有影响, $ {\rm \mathrm{C}} $ 正确;保持压强不变,充入 $ {\rm {\mathrm{N}}_{2}} $ 使容器容积变大,反应物浓度变小,反应速率减小, $ {\rm \mathrm{D}} $ 错误。
9.反应 $ {\rm a\mathrm{A}(\mathrm{g})+b\mathrm{B}(\mathrm{g})\xlongequal{}c\mathrm{C}(\mathrm{g})} $ 在容积和温度恒定的容器中进行,在某一分钟内测得:A减少 $ {\rm 0.15\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1} ,B} $ 减少 $ {\rm 0.05\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1} ,C} $ 增加 $ {\rm 0.1\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}} $ ,则下列叙述正确的是( )
A. 随着反应的进行,体系的压强逐渐增大
B. 化学计量数之比 $ a:b:c=3:1:2 $
C. 单位时间内反应物浓度的减少量等于生成物浓度的增加量
D. 若在前 $ 10\mathrm{s} $ 内A减少了 $ x\mathrm{m}\mathrm{o}\mathrm{l} $ ,则在前 $ 20\mathrm{s} $ 内A减少了 $ 2x\mathrm{m}\mathrm{o}\mathrm{l} $
答案:B
解析:随着反应的进行,气体的总物质的量浓度逐渐减小,在容器容积和温度不变的条件下,气体物质的量减小,体系的压强逐渐减小, $ {\rm \mathrm{A}} $ 错误;各物质浓度变化量之比等于化学计量数之比,则 $ a:b:c=0.15:0.05:0.1=3:1:2 $ , $ {\rm \mathrm{B}} $ 正确;由题干信息可知,单位时间内反应物浓度的减少量与生成物浓度的增加量不相等, $ {\rm \mathrm{C}} $ 错误;第2个 $ 10\mathrm{s} $ 内的反应速率比前 $ 10\mathrm{s} $ 内小,故第2个 $ 10\mathrm{s} $ 内减少的 $ {\rm \mathrm{A}} $ 的物质的量小于 $ x\mathrm{m}\mathrm{o}\mathrm{l} $ ,前 $ 20\mathrm{s} $ 内减少的 $ {\rm \mathrm{A}} $ 的物质的量小于 $ 2x\mathrm{m}\mathrm{o}\mathrm{l} $ , $ {\rm \mathrm{D}} $ 错误。
10.在某温度和容积不变的密闭容器中,A气体与B气体反应生成C气体。反应过程中,反应物与生成物的浓度随时间变化的曲线如图所示,则下列叙述正确的是( )
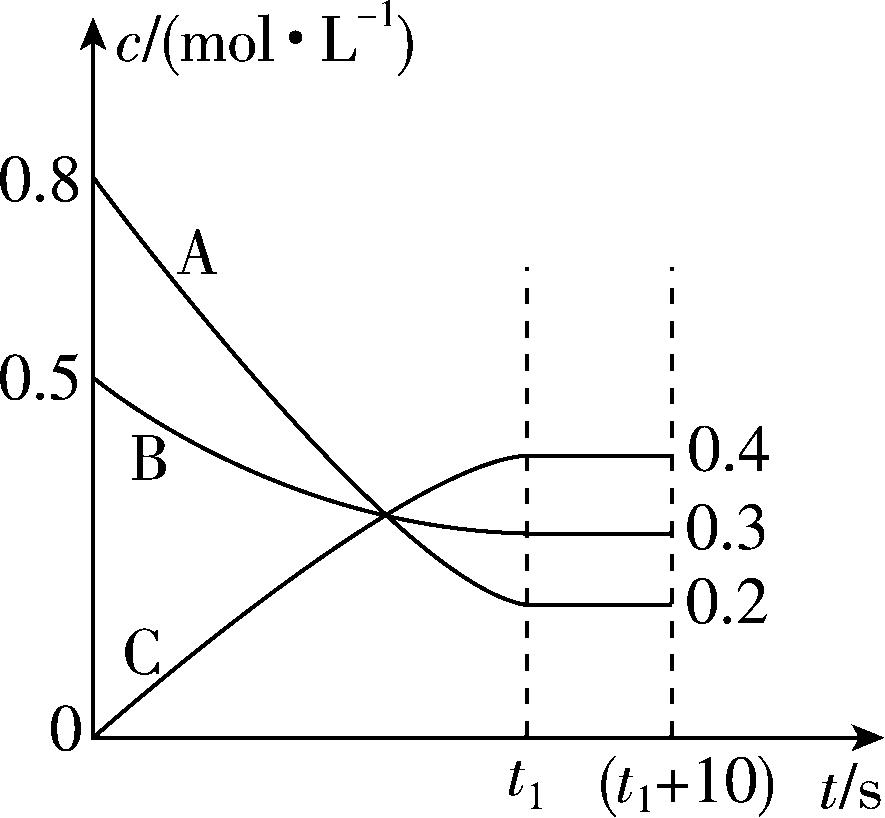
A. 该反应的化学方程式为 $ {\rm \mathrm{A}(\mathrm{g})+3\mathrm{B}(\mathrm{g})⇌2\mathrm{C}(\mathrm{g})} $
B. $ {t}_{1}\mathrm{s} $ 时该反应已停止
C. 恒温恒容条件下充入氩气,使容器压强增大,则反应速率不变
D. $ {t}_{1}\mathrm{s} $ 时,反应物A的转化率为 $ 25\% $
答案:C
解析: $ 0\sim {t}_{1}\mathrm{s} $ , $ {\rm \mathrm{A}} $ 的浓度减小了 $ {\rm 0.8\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}-0.2\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}=0.6\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}} $ , $ {\rm \mathrm{B}} $ 的浓度减小了 $ {\rm 0.5\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}-0.3\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}=0.2\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}} $ , $ {\rm \mathrm{C}} $ 的浓度增大了 $ {\rm 0.4\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}} $ ,根据各物质浓度变化量之比等于化学计量数之比,可得该反应的化学方程式为 $ {\rm 3\mathrm{A}(\mathrm{g})+\mathrm{B}(\mathrm{g})⇌2\mathrm{C}(\mathrm{g})} $ , $ {\rm \mathrm{A}} $ 错误; $ {t}_{1}\mathrm{s} $ 时,反应达到平衡状态,正、逆反应速率相等且不为0,反应并没有停止,是动态平衡, $ {\rm \mathrm{B}} $ 错误;恒温恒容条件下充入氩气,使容器压强增大,但是反应物和产物浓度不变,则反应速率不变, $ {\rm \mathrm{C}} $ 正确;设反应容器容积为 $ {\rm V\mathrm{L}} $ ,由图可知, $ {t}_{1}\mathrm{s} $ 时,反应物 $ {\rm \mathrm{A}} $ 的转化率 $ {\rm =\dfrac{(0.8-0.2)V\mathrm{m}\mathrm{o}\mathrm{l}}{0.8V\mathrm{m}\mathrm{o}\mathrm{l}}×100\%=75\%} $ , $ {\rm \mathrm{D}} $ 错误。
11.为了探究外界条件对 $ {\rm {\mathrm{H}}_{2}{\mathrm{O}}_{2}} $ 分解反应速率的影响,某同学分别在三支试管中加入了相同体积的 $ {\rm {\mathrm{H}}_{2}{\mathrm{O}}_{2}} $ 溶液,并测量收集 $ {\rm V\mathrm{m}\mathrm{L}} $ 气体所需的时间,实验记录如下:
实验序号 | $ {\rm {\mathrm{H}}_{2}{\mathrm{O}}_{2}} $ 溶液浓度 | 催化剂 | 所用时间 |
① | $ 5\% $ | 2滴 $ {\rm 1\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}{\mathrm{F}\mathrm{e}\mathrm{C}\mathrm{l}}_{3}} $ 溶液 | $ {t}_{1} $ |
② | $ 10\% $ | 2滴 $ {\rm 1\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}{\mathrm{F}\mathrm{e}\mathrm{C}\mathrm{l}}_{3}} $ 溶液 | $ {t}_{2} $ |
③ | $ 10\% $ | 2滴 $ {\rm 1\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}{\mathrm{C}\mathrm{u}\mathrm{S}\mathrm{O}}_{4}} $ 溶液 | $ {t}_{3} $ |
下列结论错误的是( )
A. 实验①②研究的是浓度对反应速率的影响
B. 实验②③研究的是不同催化剂对反应速率的影响
C. 若 $ {t}_{3} > {t}_{2} $ ,则说明 $ {\rm {\mathrm{F}\mathrm{e}}^{3+}} $ 比 $ {\rm {\mathrm{C}\mathrm{u}}^{2+}} $ 对 $ {\rm {\mathrm{H}}_{2}{\mathrm{O}}_{2}} $ 分解催化效果好
D. 若探究温度对反应速率的影响,该实验不宜过度加热
答案:C
解析:实验①②中过氧化氢的浓度不同,其他因素相同,则其研究的是浓度对反应速率的影响, $ {\rm \mathrm{A}} $ 正确;实验②③中过氧化氢浓度相同,②中加入的催化剂是氯化铁,③中加入的催化剂是硫酸铜,研究的是不同催化剂对反应速率的影响, $ {\rm \mathrm{B}} $ 正确;实验②③中,两种催化剂的阳离子和阴离子均不同,若 $ {t}_{3} > {t}_{2} $ ,不能说明 $ {\rm {\mathrm{F}\mathrm{e}}^{3+}} $ 比 $ {\rm {\mathrm{C}\mathrm{u}}^{2+}} $ 对 $ {\rm {\mathrm{H}}_{2}{\mathrm{O}}_{2}} $ 分解催化效果好, $ {\rm \mathrm{C}} $ 错误;过度加热会导致较多的水蒸气混入气体中,影响气体体积的测定, $ {\rm \mathrm{D}} $ 正确。
12.硫代硫酸钠 $ {\rm ({\mathrm{N}\mathrm{a}}_{2}{\mathrm{S}}_{2}{\mathrm{O}}_{3})} $ 是重要的还原剂,能被酸性 $ {\rm {\mathrm{K}\mathrm{M}\mathrm{n}\mathrm{O}}_{4}} $ 溶液氧化,反应原理如下: $ {\rm 5{\mathrm{N}\mathrm{a}}_{2}{\mathrm{S}}_{2}{\mathrm{O}}_{3}+8{\mathrm{K}\mathrm{M}\mathrm{n}\mathrm{O}}_{4}+7{\mathrm{H}}_{2}{\mathrm{S}\mathrm{O}}_{4}\xlongequal{}8{\mathrm{M}\mathrm{n}\mathrm{S}\mathrm{O}}_{4}+5{\mathrm{N}\mathrm{a}}_{2}{\mathrm{S}\mathrm{O}}_{4}+4{\mathrm{K}}_{2}{\mathrm{S}\mathrm{O}}_{4}+7{\mathrm{H}}_{2}\mathrm{O}} $ 。某学习小组为探究影响该化学反应速率的因素,设计了如表所示系列实验。
实验序号 | 温度/ $ ℃ $ | $ {\rm V/\mathrm{m}\mathrm{L}} $ | 紫色恰好褪去的时间/ $ \mathrm{s} $ |
稀硫酸 $ {\rm (1.5000\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1})} $ | 蒸馏水 | $ {\rm {\mathrm{N}\mathrm{a}}_{2}{\mathrm{S}}_{2}{\mathrm{O}}_{3}} $ 溶液 $ {\rm (0.1250\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1})} $ | $ {\rm {\mathrm{K}\mathrm{M}\mathrm{n}\mathrm{O}}_{4}} $ 溶液 $ {\rm (0.2500\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1})} $ |
① | 25 | 5.00 | 0 | 25.00 | 10.00 | $ {t}_{1} $ |
② | 25 | 5.00 | 10.00 | 15.00 | $ {\rm {V}_{1}} $ | $ {t}_{2} $ |
③ | 40 | $ {\rm {V}_{2}} $ | $ {\rm {V}_{3}} $ | 15.00 | $ {\rm {V}_{4}} $ | $ {t}_{3} $ |
下列说法错误的是( )
A. 实验②和③探究温度对反应速率的影响,则需 $ {\rm {V}_{3}={V}_{4}=10.00} $
B. $ {t}_{1} < {t}_{2} $ , $ {t}_{3} < {t}_{2} $
C. 实验中除能观察到溶液紫色褪去外还能观察到溶液变浑浊
D. 若实验①中, $ {t}_{1}=5\mathrm{s} $ ,则前 $ 5\mathrm{s} $ 内平均反应速率 $ {\rm v({\mathrm{K}\mathrm{M}\mathrm{n}\mathrm{O}}_{4})=0.0500\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}\cdot {\mathrm{s}}^{-1}} $
答案:D
解析:实验①和②的 $ {\rm {\mathrm{N}\mathrm{a}}_{2}{\mathrm{S}}_{2}{\mathrm{O}}_{3}} $ 溶液体积不同,探究 $ {\rm {\mathrm{N}\mathrm{a}}_{2}{\mathrm{S}}_{2}{\mathrm{O}}_{3}} $ 溶液浓度对该反应速率的影响,则其他条件应保持相同,溶液总体积为 $ {\rm 40.00\mathrm{m}\mathrm{L}} $ ,实验②中蒸馏水为 $ {\rm 10.00\mathrm{m}\mathrm{L}} $ ,则 $ {\rm {V}_{1}=10.00} $ ;实验②和③温度不同,则保持其他条件相同,即实验③中 $ {\rm {V}_{2}=5.00} $ 、 $ {\rm {V}_{3}=10.00} $ , $ {\rm {V}_{4}=10.00} $ , $ {\rm \mathrm{A}} $ 正确。实验①和②温度相同,但实验②混合溶液中 $ {\rm {\mathrm{N}\mathrm{a}}_{2}{\mathrm{S}}_{2}{\mathrm{O}}_{3}} $ 浓度较低,反应速率更慢,故 $ {t}_{1} < {t}_{2} $ ;实验②和③中仅温度不同,其他条件相同,实验③温度更高,反应速率更快,故 $ {t}_{3} < {t}_{2} $ , $ {\rm \mathrm{B}} $ 正确。 $ {\rm {\mathrm{K}\mathrm{M}\mathrm{n}\mathrm{O}}_{4}} $ 物质的量为 $ 0.25×10×{10}^{-3}\mathrm{m}\mathrm{o}\mathrm{l}=2.5×{10}^{-3}\mathrm{m}\mathrm{o}\mathrm{l} $ ,实验②和③中硫酸物质的量为 $ 1.5×5×{10}^{-3}\mathrm{m}\mathrm{o}\mathrm{l}=7.5×{10}^{-3}\mathrm{m}\mathrm{o}\mathrm{l} $ ,硫代硫酸钠物质的量为 $ 0.125×15×{10}^{-3}\mathrm{m}\mathrm{o}\mathrm{l}=1.875×{10}^{-3}\mathrm{m}\mathrm{o}\mathrm{l} $ ,根据化学方程式 $ {\rm 5{\mathrm{N}\mathrm{a}}_{2}{\mathrm{S}}_{2}{\mathrm{O}}_{3}+8{\mathrm{K}\mathrm{M}\mathrm{n}\mathrm{O}}_{4}+7{\mathrm{H}}_{2}{\mathrm{S}\mathrm{O}}_{4}\xlongequal{}8{\mathrm{M}\mathrm{n}\mathrm{S}\mathrm{O}}_{4}+5{\mathrm{N}\mathrm{a}}_{2}{\mathrm{S}\mathrm{O}}_{4}+4{\mathrm{K}}_{2}{\mathrm{S}\mathrm{O}}_{4}+7{\mathrm{H}}_{2}\mathrm{O}} $ , $ {\rm {\mathrm{K}\mathrm{M}\mathrm{n}\mathrm{O}}_{4}} $ 完全反应, $ {\rm {\mathrm{N}\mathrm{a}}_{2}{\mathrm{S}}_{2}{\mathrm{O}}_{3}} $ 与 $ {\rm {\mathrm{H}}_{2}{\mathrm{S}\mathrm{O}}_{4}} $ 过量,酸性条件下, $ {\rm {\mathrm{S}}_{2}{\mathrm{O}}_{3}^{2-}} $ 发生歧化反应生成 $ {\rm \mathrm{S}} $ 和 $ {\rm {\mathrm{S}\mathrm{O}}_{2}} $ ,因此实验中除能观察到溶液紫色褪去外还能观察到溶液变浑浊, $ {\rm \mathrm{C}} $ 正确。实验①中 $ {\rm {\mathrm{K}\mathrm{M}\mathrm{n}\mathrm{O}}_{4}} $ 的初始浓度为 $ {\rm \dfrac{0.25×10}{40}\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}=0.0625\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}} $ (稀释后),初始至完全反应时平均速率 $ {\rm v({\mathrm{K}\mathrm{M}\mathrm{n}\mathrm{O}}_{4})=\dfrac{0.0625}{5}\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}\cdot {\mathrm{s}}^{-1}=0.0125\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}\cdot {\mathrm{s}}^{-1}} $ , $ {\rm \mathrm{D}} $ 错误。

