课时2 化学反应与电能
一、刷基础
1.理论上,下列反应能设计成原电池的是( )
A. $ {\rm 2{\mathrm{F}\mathrm{e}\mathrm{C}\mathrm{l}}_{3}+\mathrm{F}\mathrm{e}\xlongequal{}3{\mathrm{F}\mathrm{e}\mathrm{C}\mathrm{l}}_{2}} $
B. $ {\rm {\mathrm{N}\mathrm{a}\mathrm{H}\mathrm{C}\mathrm{O}}_{3}+\mathrm{H}\mathrm{C}\mathrm{l}\xlongequal{}\mathrm{N}\mathrm{a}\mathrm{C}\mathrm{l}+{\mathrm{H}}_{2}\mathrm{O}+{\mathrm{C}\mathrm{O}}_{2}↑} $
C. $ {\rm \mathrm{C}\mathrm{a}\mathrm{O}+{\mathrm{H}}_{2}\mathrm{O}\xlongequal{}\mathrm{C}\mathrm{a}(\mathrm{O}\mathrm{H})_{2}} $
D. $ {\rm 2\mathrm{N}\mathrm{a}\mathrm{O}\mathrm{H}+{\mathrm{H}}_{2}{\mathrm{S}\mathrm{O}}_{4}\xlongequal{}{\mathrm{N}\mathrm{a}}_{2}{\mathrm{S}\mathrm{O}}_{4}+2{\mathrm{H}}_{2}\mathrm{O}} $
答案:A
解析: $ {\rm \mathrm{F}\mathrm{e}} $ 与 $ {\rm {\mathrm{F}\mathrm{e}}^{3+}} $ 反应生成 $ {\rm {\mathrm{F}\mathrm{e}}^{2+}} $ ,存在 $ {\rm \mathrm{F}\mathrm{e}} $ 的氧化 $ (0\to +2) $ 和 $ {\rm {\mathrm{F}\mathrm{e}}^{3+}} $ 的还原 $ (+3\to +2) $ ,是氧化还原反应,可设计成原电池, $ {\rm \mathrm{A}} $ 正确; $ {\rm {\mathrm{N}\mathrm{a}\mathrm{H}\mathrm{C}\mathrm{O}}_{3}} $ 与 $ {\rm \mathrm{H}\mathrm{C}\mathrm{l}} $ 的反应为复分解反应,无元素化合价变化,无电子转移,无法形成原电池, $ {\rm \mathrm{B}} $ 错误; $ {\rm \mathrm{C}\mathrm{a}\mathrm{O}} $ 与水反应生成 $ {\rm \mathrm{C}\mathrm{a}(\mathrm{O}\mathrm{H})_{2}} $ ,不是氧化还原反应,无电子转移,无法形成原电池, $ {\rm \mathrm{C}} $ 错误; $ {\rm \mathrm{N}\mathrm{a}\mathrm{O}\mathrm{H}} $ 与 $ {\rm {\mathrm{H}}_{2}{\mathrm{S}\mathrm{O}}_{4}} $ 的中和反应为复分解反应,无电子转移,无法形成原电池, $ {\rm \mathrm{D}} $ 错误。
2.在如图所示的8个装置中,能实现化学能转化为电能的是( )
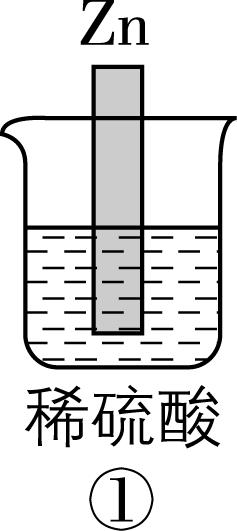
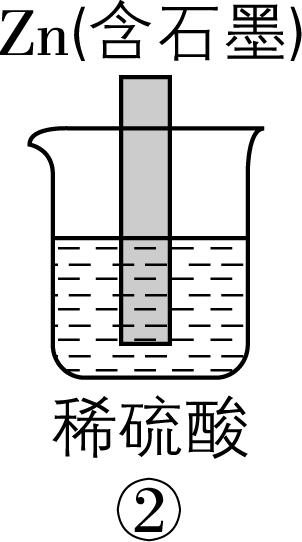
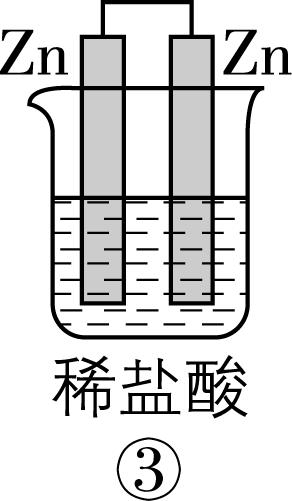
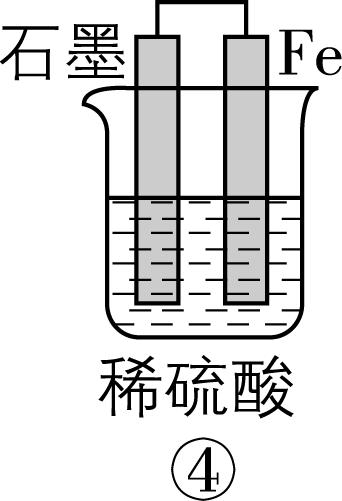
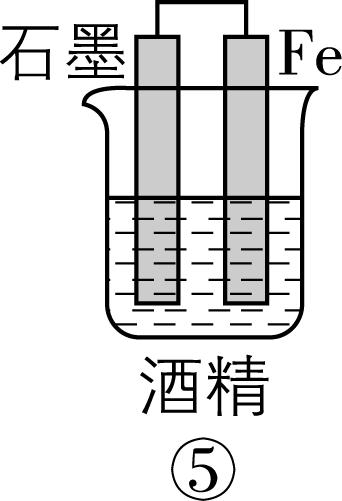
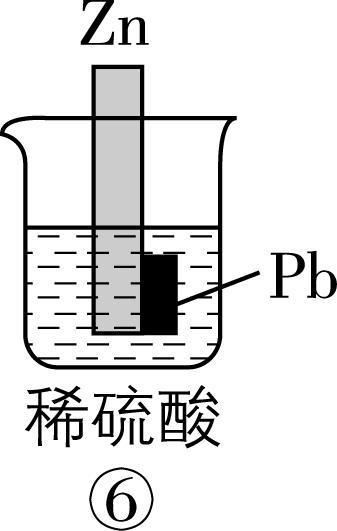
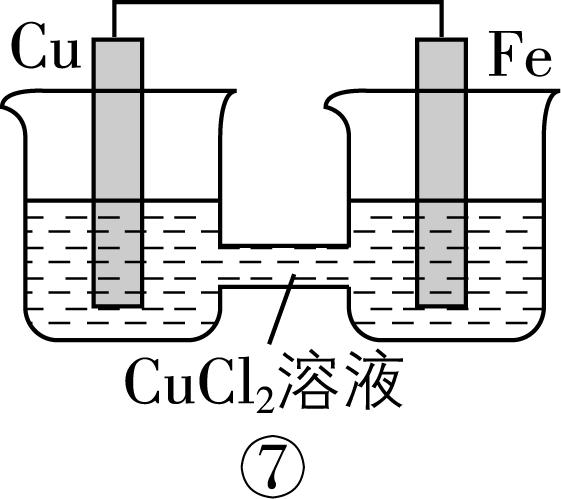
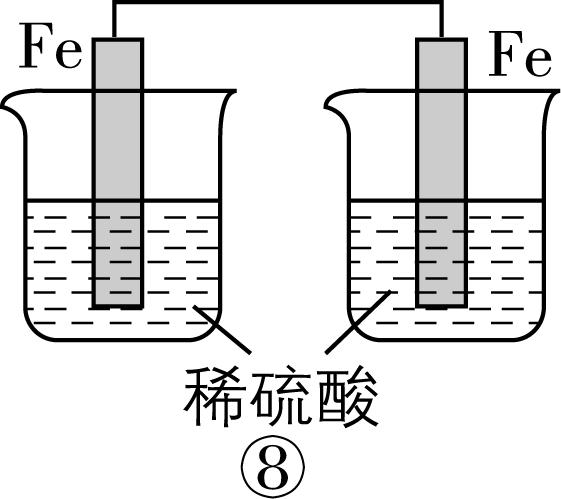
A. ②④⑥⑦
B. ①③⑤
C. ④⑧
D. ②③⑥
答案:A
解析:原电池可以把化学能转化为电能,构成原电池的条件:能自发进行的氧化还原反应,形成闭合回路,有两个活泼性不同的电极,存在电解质溶液。
装置序号 | 自发氧化还原反应 | 两个活泼性不同的电极 | 电解质溶液 | 闭合回路 | 形成原电池 | 化学能 $ \to $ 电能 |
① | 有 | 无 | 有 | 否 | × | 不能 |
② | 有 | 有 | 有 | 是 | √ | 能 |
③ | 有 | 无 | 有 | 是 | × | 不能 |
④ | 有 | 有 | 有 | 是 | √ | 能 |
⑤ | 无 | 有 | 无 | 否 | × | 不能 |
⑥ | 有 | 有 | 有 | 是 | √ | 能 |
⑦ | 有 | 有 | 有 | 是 | √ | 能 |
⑧ | 有 | 无 | 有 | 否 | × | 不能 |
故选 $ {\rm \mathrm{A}} $ 。
3.如图为发光二极管连接柠檬电池。下列说法不正确的是( )
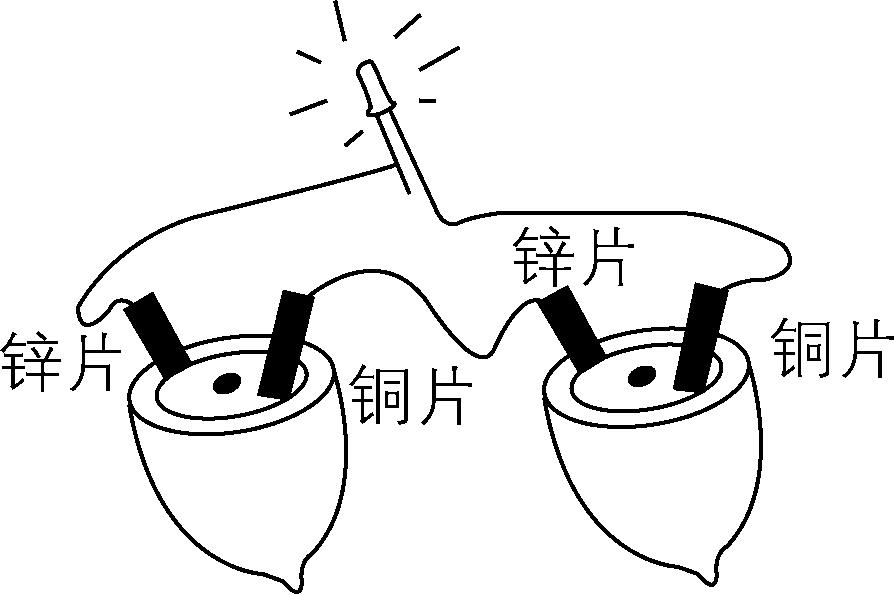
A. 该装置的能量转化形式主要为化学能 $ \to $ 电能 $ \to $ 光能
B. 电子的流向: $ {\rm \mathrm{Z}\mathrm{n}\to} $ 导线 $ {\rm \to \mathrm{C}\mathrm{u}\to} $ 柠檬液 $ {\rm \to \mathrm{Z}\mathrm{n}} $
C. 锌片是负极,质量不断减小
D. 铜片上的电极反应为 $ {\rm 2{\mathrm{H}}^{+}+2{\mathrm{e}}^{-}\xlongequal{}{\mathrm{H}}_{2}↑} $
答案:B
解析:该装置为原电池,锌的金属活动性比铜强,锌片为负极,铜片为正极,柠檬液显酸性,含 $ {\rm {\mathrm{H}}^{+}} $ ,可作电解液,该装置的能量转化形式主要为化学能 $ \to $ 电能 $ \to $ 光能, $ {\rm \mathrm{A}} $ 正确;原电池中电子由负极沿导线流向正极,即电子的流向为 $ {\rm \mathrm{Z}\mathrm{n}\to} $ 导线 $ {\rm \to \mathrm{C}\mathrm{u}} $ , $ {\rm \mathrm{B}} $ 错误;锌片是负极,电极反应为 $ {\rm \mathrm{Z}\mathrm{n}-2{\mathrm{e}}^{-}\xlongequal{}{\mathrm{Z}\mathrm{n}}^{2+}} $ ,其质量不断减小, $ {\rm \mathrm{C}} $ 正确;铜片为正极,电极反应为 $ {\rm 2{\mathrm{H}}^{+}+2{\mathrm{e}}^{-}\xlongequal{}{\mathrm{H}}_{2}↑} $ , $ {\rm \mathrm{D}} $ 正确。
4.银锌纽扣电池是一种常见的化学电源,以 $ {\rm \mathrm{Z}\mathrm{n}} $ 和 $ {\rm {\mathrm{A}\mathrm{g}}_{2}\mathrm{O}} $ 为电极,氢氧化钾溶液为电解质溶液,其电池反应为 $ {\rm \mathrm{Z}\mathrm{n}+{\mathrm{A}\mathrm{g}}_{2}\mathrm{O}+{\mathrm{H}}_{2}\mathrm{O}\xlongequal{}\mathrm{Z}\mathrm{n}(\mathrm{O}\mathrm{H})_{2}+2\mathrm{A}\mathrm{g}} $ ,装置示意图如图。下列说法不正确的是( )
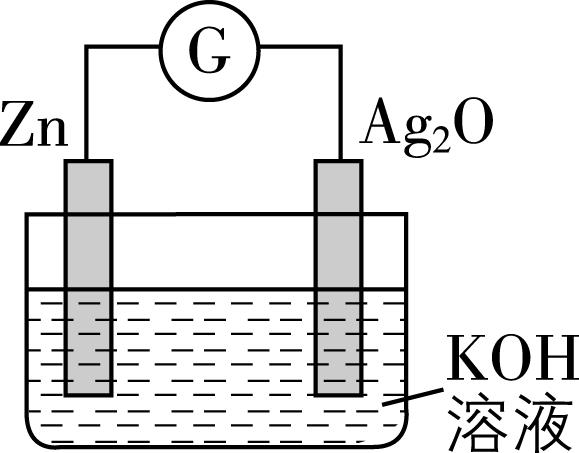
A. 电池工作时化学能主要转化为电能
B. $ {\rm \mathrm{Z}\mathrm{n}} $ 电极是该电池的负极
C. $ {\rm {\mathrm{A}\mathrm{g}}_{2}\mathrm{O}} $ 电极发生还原反应
D. 电池工作时,电子从 $ {\rm \mathrm{Z}\mathrm{n}} $ 经氢氧化钾溶液流向 $ {\rm {\mathrm{A}\mathrm{g}}_{2}\mathrm{O}} $
答案:D
解析:该装置为原电池,是将化学能转化为电能的装置,因此电池工作时化学能主要转化为电能, $ {\rm \mathrm{A}} $ 正确;在反应中 $ {\rm \mathrm{Z}\mathrm{n}} $ 元素的化合价由0价变为 $ +2 $ 价,化合价升高,失去电子被氧化,因此 $ {\rm \mathrm{Z}\mathrm{n}} $ 电极是该电池的负极, $ {\rm \mathrm{B}} $ 正确;在反应中 $ {\rm \mathrm{A}\mathrm{g}} $ 元素的化合价由 $ +1 $ 价变为0价,化合价降低,得到电子被还原,故 $ {\rm {\mathrm{A}\mathrm{g}}_{2}\mathrm{O}} $ 电极发生还原反应, $ {\rm \mathrm{C}} $ 正确;电池工作时,电子从负极 $ {\rm \mathrm{Z}\mathrm{n}} $ 经导线流向正极 $ {\rm {\mathrm{A}\mathrm{g}}_{2}\mathrm{O}} $ ,不能通过电解质溶液, $ {\rm \mathrm{D}} $ 错误。
5.原电池的应用促进了人类社会的发展。有原电池装置如图甲、乙、丙所示:
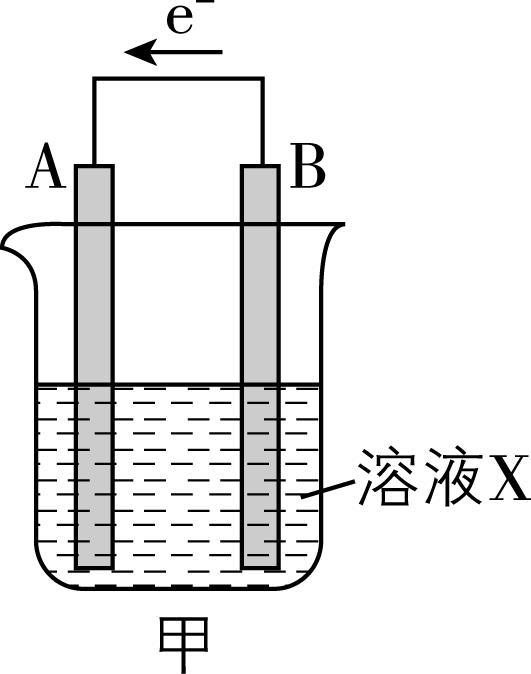
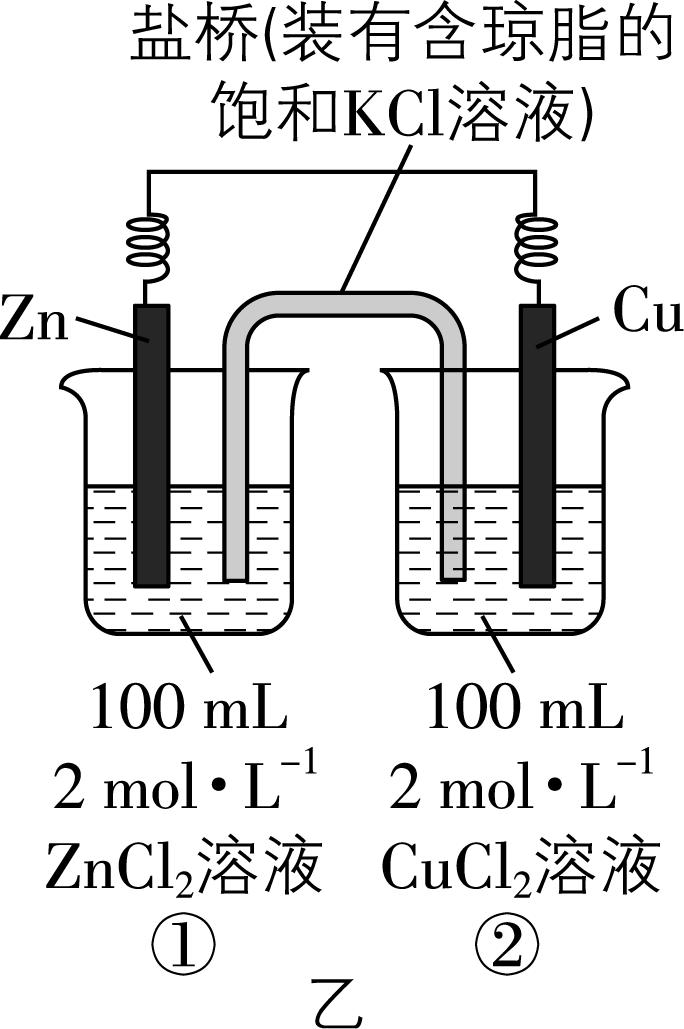
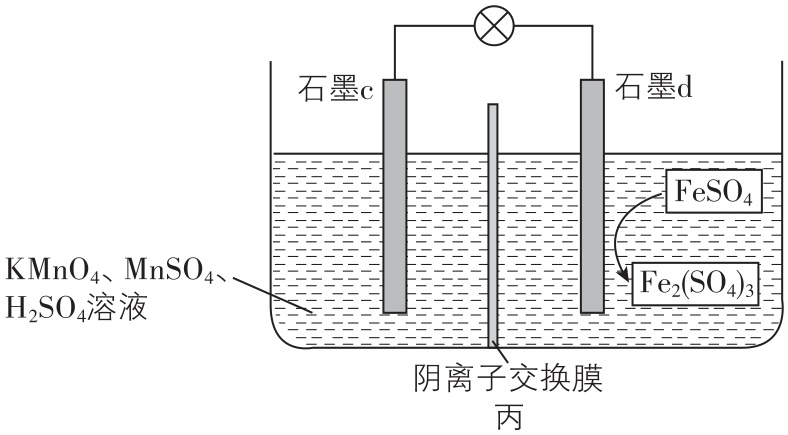
已知:盐桥的作用是平衡电荷,电池工作时,阴、阳离子分别向负极、正极移动。回答下列问题:
(1) 图甲、乙、丙中负极材料分别是 (填“A”或“B”)、 (填“ $ {\rm \mathrm{Z}\mathrm{n}} $ ”或“ $ {\rm \mathrm{C}\mathrm{u}} $ ”)、 (填“石墨 $ \mathrm{c} $ ”或“石墨 $ \mathrm{d} $ ”)。
(2) 图甲中,若B电极为 $ {\rm \mathrm{F}\mathrm{e}} $ ,溶液 $ {\rm \mathrm{X}} $ 为稀硫酸,反应进行一段时间后溶液中 $ {\rm {\mathrm{H}}^{+}} $ 的物质的量浓度 (填“增大”“减小”或“基本不变”)。
(3) 图乙装置工作时,盐桥中的 $ {\rm {\mathrm{K}}^{+}} $ 移向烧杯 (填“①”或“②”),原电池总反应为 (填离子方程式)。
(4) 若图乙装置电路中转移 $ 0.2\mathrm{m}\mathrm{o}\mathrm{l} $ 电子,则两电极质量相差 $ \mathrm{g} $ 。
(5) 图丙装置中左侧观察到的现象为 ,发生的电极反应式为 。
答案:(1) B; $ {\rm \mathrm{Z}\mathrm{n}} $ ;石墨 $ \mathrm{d} $
(2) 减小
(3) ②; $ {\rm \mathrm{Z}\mathrm{n}+{\mathrm{C}\mathrm{u}}^{2+}\xlongequal{}{\mathrm{Z}\mathrm{n}}^{2+}+\mathrm{C}\mathrm{u}} $
(4) 12.9
(5) 溶液颜色变浅或褪去; $ {\rm {\mathrm{M}\mathrm{n}\mathrm{O}}_{4}^{-}+5{\mathrm{e}}^{-}+8{\mathrm{H}}^{+}\xlongequal{}{\mathrm{M}\mathrm{n}}^{2+}+4{\mathrm{H}}_{2}\mathrm{O}} $
解析:(1) 图甲、乙、丙均为原电池,图甲中电子由 $ {\rm \mathrm{B}} $ 极移向 $ {\rm \mathrm{A}} $ 极,则 $ {\rm \mathrm{B}} $ 为负极;图乙中锌比铜活泼,锌失去电子,氯化铜中的铜离子得到电子,则锌是负极;图丙中石墨 $ \mathrm{d} $ 上 $ {\rm {\mathrm{F}\mathrm{e}}^{2+}} $ 失去电子变为 $ {\rm {\mathrm{F}\mathrm{e}}^{3+}} $ ,则石墨 $ \mathrm{d} $ 为负极。
(2) 图甲中,若 $ {\rm \mathrm{B}} $ 电极为 $ {\rm \mathrm{F}\mathrm{e}} $ ,溶液 $ {\rm \mathrm{X}} $ 为稀硫酸,则铁失去电子,氢离子在 $ {\rm \mathrm{A}} $ 电极得到电子生成 $ {\rm {\mathrm{H}}_{2}} $ ,则溶液中 $ {\rm {\mathrm{H}}^{+}} $ 的物质的量浓度减小。
(3) 图乙装置中锌为负极,铜为正极,在原电池中阳离子向正极移动,即盐桥中的 $ {\rm {\mathrm{K}}^{+}} $ 向烧杯②移动,原电池总反应为 $ {\rm \mathrm{Z}\mathrm{n}+{\mathrm{C}\mathrm{u}}^{2+}\xlongequal{}{\mathrm{Z}\mathrm{n}}^{2+}+\mathrm{C}\mathrm{u}} $ 。
(4) 图乙装置的总反应为 $ {\rm \mathrm{Z}\mathrm{n}+{\mathrm{C}\mathrm{u}}^{2+}\xlongequal{}{\mathrm{Z}\mathrm{n}}^{2+}+\mathrm{C}\mathrm{u}} $ ,若电路中转移 $ 0.2\mathrm{m}\mathrm{o}\mathrm{l} $ 电子,则负极会溶解 $ 0.1\mathrm{m}\mathrm{o}\mathrm{l} $ 锌,质量是 $ 6.5\mathrm{g} $ ,同时正极上析出 $ 0.1\mathrm{m}\mathrm{o}\mathrm{l} $ 铜,质量是 $ 6.4\mathrm{g} $ ,则两电极质量相差 $ 6.5\mathrm{g}+6.4\mathrm{g}=12.9\mathrm{g} $ 。
(5) 图丙装置中左侧 $ {\rm {\mathrm{M}\mathrm{n}\mathrm{O}}_{4}^{-}} $ 得到电子转化为锰离子,则可观察到的现象为溶液颜色变浅或褪去;对应的电极反应式为 $ {\rm {\mathrm{M}\mathrm{n}\mathrm{O}}_{4}^{-}+5{\mathrm{e}}^{-}+8{\mathrm{H}}^{+}\xlongequal{}{\mathrm{M}\mathrm{n}}^{2+}+4{\mathrm{H}}_{2}\mathrm{O}} $ 。
6.向等质量的两份锌粉 $ \mathrm{a} $ 、 $ \mathrm{b} $ 中分别加入过量的稀硫酸,同时向 $ \mathrm{a} $ 中加入少量的 $ {\rm {\mathrm{C}\mathrm{u}\mathrm{S}\mathrm{O}}_{4}} $ 溶液,下列各图表示的是产生 $ {\rm {\mathrm{H}}_{2}} $ 的体积 $ {\rm V} $ 与时间 $ t $ 的关系(其他条件相同),其中正确的是( )
A. 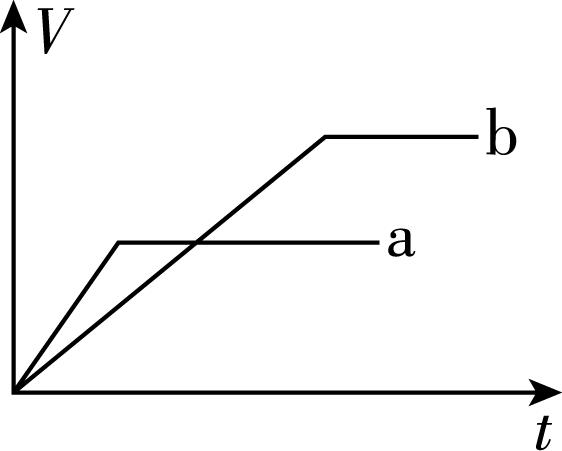
B. 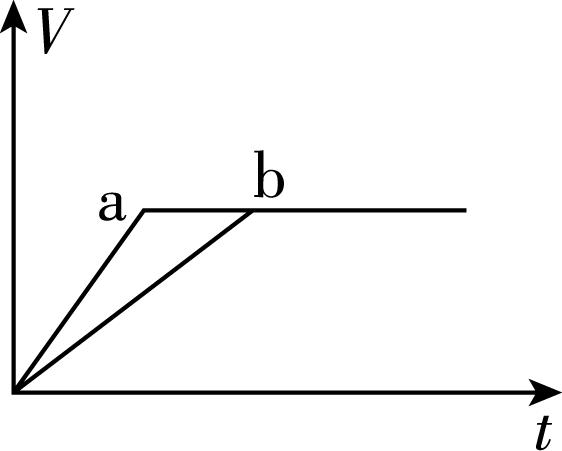
C. 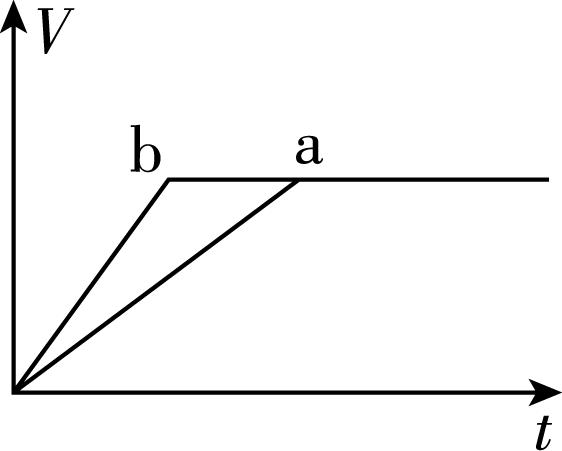
D. 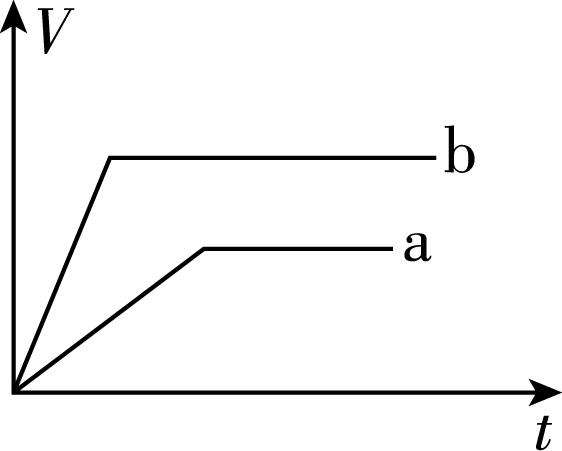
答案:A
解析:锌和硫酸反应,加入硫酸铜溶液后,锌会先置换出金属铜,形成锌—铜—稀硫酸原电池,加快金属锌和稀硫酸反应的速率,所以反应速率: $ \mathrm{a} > \mathrm{b} $ ;由于稀硫酸过量,产生氢气的量取决于金属锌的质量,而 $ \mathrm{a} $ 中一部分金属锌用于置换金属铜,导致和稀硫酸反应生成氢气的量减少,所以生成氢气的体积: $ \mathrm{a} < \mathrm{b} $ 。选 $ {\rm \mathrm{A}} $ 。
7.A、B、C、D四种金属按表中装置进行实验。根据实验现象,下列判断错误的是( )
A. 装置甲的溶液中,阴离子移向A极
B. 装置乙中正极的电极反应式为 $ {\rm {\mathrm{C}\mathrm{u}}^{2+}+2{\mathrm{e}}^{-}\xlongequal{}\mathrm{C}\mathrm{u}} $
C. 四种金属活动性由强到弱的顺序是 $ {\rm \mathrm{D} > \mathrm{A} > \mathrm{B} > \mathrm{C}} $
D. 装置丙的溶液中,电子从D流向A
答案:D
解析:装置甲中,电子从 $ {\rm \mathrm{A}} $ 到 $ {\rm \mathrm{B}} $ ,则 $ {\rm \mathrm{A}} $ 作负极, $ {\rm \mathrm{B}} $ 为正极;装置乙中, $ {\rm \mathrm{C}} $ 的质量增加,则 $ {\rm \mathrm{C}} $ 为正极, $ {\rm \mathrm{B}} $ 为负极;装置丙中, $ {\rm \mathrm{A}} $ 上有气泡产生,则 $ {\rm \mathrm{A}} $ 为正极, $ {\rm \mathrm{D}} $ 为负极。原电池工作时阴离子由正极向负极移动,即装置甲中阴离子由 $ {\rm \mathrm{B}} $ 极移向 $ {\rm \mathrm{A}} $ 极, $ {\rm \mathrm{A}} $ 正确;装置乙中, $ {\rm \mathrm{C}} $ 为正极,正极发生还原反应,电极反应式为 $ {\rm {\mathrm{C}\mathrm{u}}^{2+}+2{\mathrm{e}}^{-}\xlongequal{}\mathrm{C}\mathrm{u}} $ , $ {\rm \mathrm{B}} $ 正确;原电池装置中,负极的金属活动性强于正极,则四种金属活动性由强到弱的顺序是 $ {\rm \mathrm{D} > \mathrm{A} > \mathrm{B} > \mathrm{C}} $ , $ {\rm \mathrm{C}} $ 正确;装置丙中, $ {\rm \mathrm{A}} $ 上有气泡产生,则 $ {\rm \mathrm{A}} $ 为正极, $ {\rm \mathrm{D}} $ 为负极,电子流向: $ {\rm \mathrm{D}\to} $ 导线 $ {\rm \to \mathrm{A}} $ ,不经过电解质溶液, $ {\rm \mathrm{D}} $ 错误。
8.负载有 $ {\rm \mathrm{P}\mathrm{t}} $ 和 $ {\rm \mathrm{A}\mathrm{g}} $ 的活性炭,可选择性去除 $ {\rm {\mathrm{C}\mathrm{l}}^{-}} $ 实现废酸溶液的纯化,其工作原理如图。下列说法正确的是( )
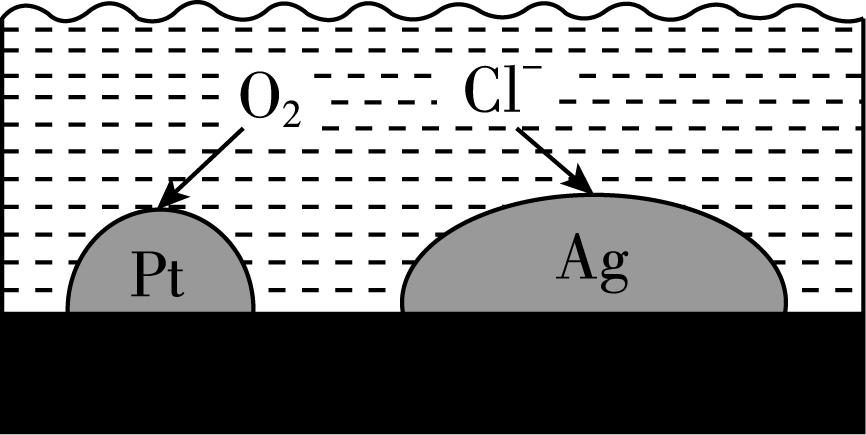
A. $ {\rm \mathrm{A}\mathrm{g}} $ 作原电池正极
B. $ {\rm \mathrm{P}\mathrm{t}} $ 表面发生的电极反应: $ {\rm {\mathrm{O}}_{2}+2{\mathrm{H}}_{2}\mathrm{O}+4{\mathrm{e}}^{-}\xlongequal{}4{\mathrm{O}\mathrm{H}}^{-}} $
C. 工作一段时间后, $ {\rm \mathrm{P}\mathrm{t}} $ 电极附近 $ {\rm \mathrm{p}\mathrm{H}} $ 变大
D. 每消耗标准状况下 $ {\rm 22.4\mathrm{L}} $ 的 $ {\rm {\mathrm{O}}_{2}} $ ,最多去除 $ {\rm 2\mathrm{m}\mathrm{o}\mathrm{l}{\mathrm{C}\mathrm{l}}^{-}} $
答案:C
解析:由分析可知, $ {\rm \mathrm{A}\mathrm{g}} $ 为负极, $ {\rm \mathrm{A}} $ 错误;溶液为酸性,故 $ {\rm \mathrm{P}\mathrm{t}} $ 表面发生的电极反应为 $ {\rm {\mathrm{O}}_{2}+4{\mathrm{H}}^{+}+4{\mathrm{e}}^{-}\xlongequal{}2{\mathrm{H}}_{2}\mathrm{O}} $ , $ {\rm \mathrm{B}} $ 错误;工作一段时间后, $ {\rm \mathrm{P}\mathrm{t}} $ 电极附近溶液中 $ {\rm c({\mathrm{H}}^{+})} $ 减小, $ {\rm \mathrm{p}\mathrm{H}} $ 变大, $ {\rm \mathrm{C}} $ 正确;由思路导引及得失电子守恒可得关系式: $ {\rm {\mathrm{O}}_{2}\sim 4\mathrm{A}\mathrm{g}\sim 4{\mathrm{C}\mathrm{l}}^{-}\sim 4\mathrm{A}\mathrm{g}\mathrm{C}\mathrm{l}} $ ,则每消耗标准状况下 $ {\rm 22.4\mathrm{L}(1\mathrm{m}\mathrm{o}\mathrm{l})} $ 的 $ {\rm {\mathrm{O}}_{2}} $ ,转移 $ 4\mathrm{m}\mathrm{o}\mathrm{l} $ 电子,最多去除 $ {\rm 4\mathrm{m}\mathrm{o}\mathrm{l}{\mathrm{C}\mathrm{l}}^{-}} $ , $ {\rm \mathrm{D}} $ 错误。
9.化学电源在日常生活和高科技领域中有广泛应用,下列说法正确的是( )
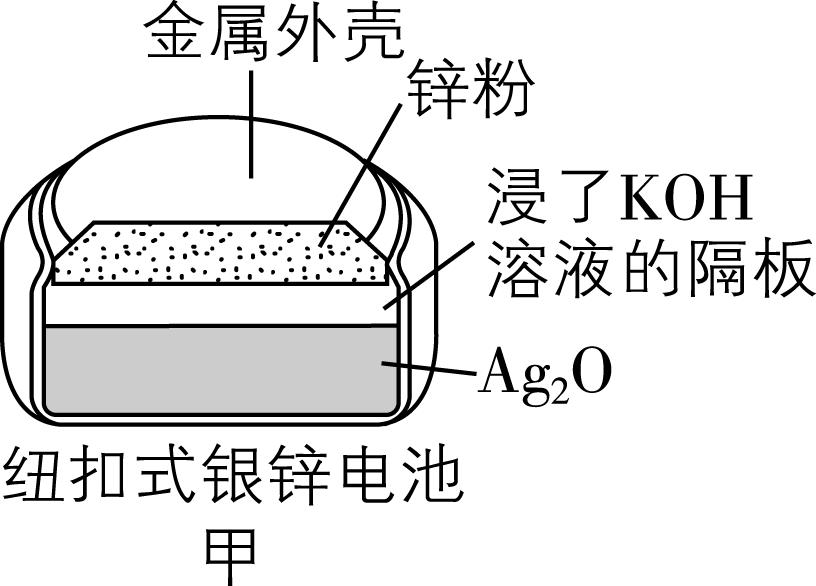
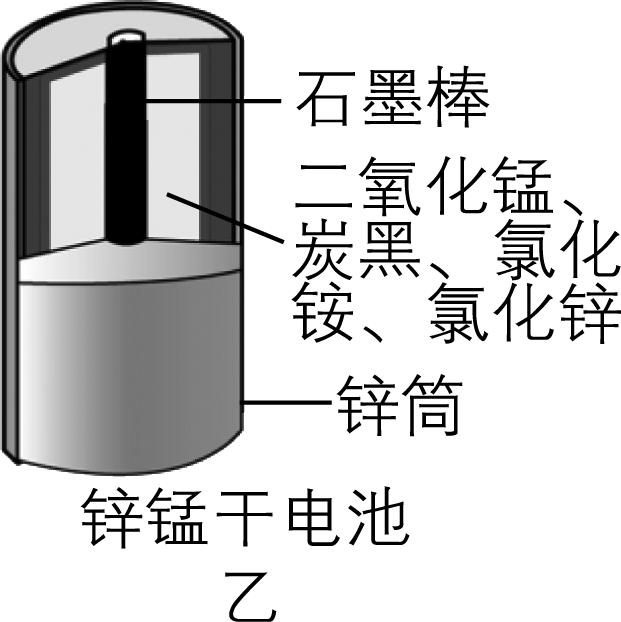

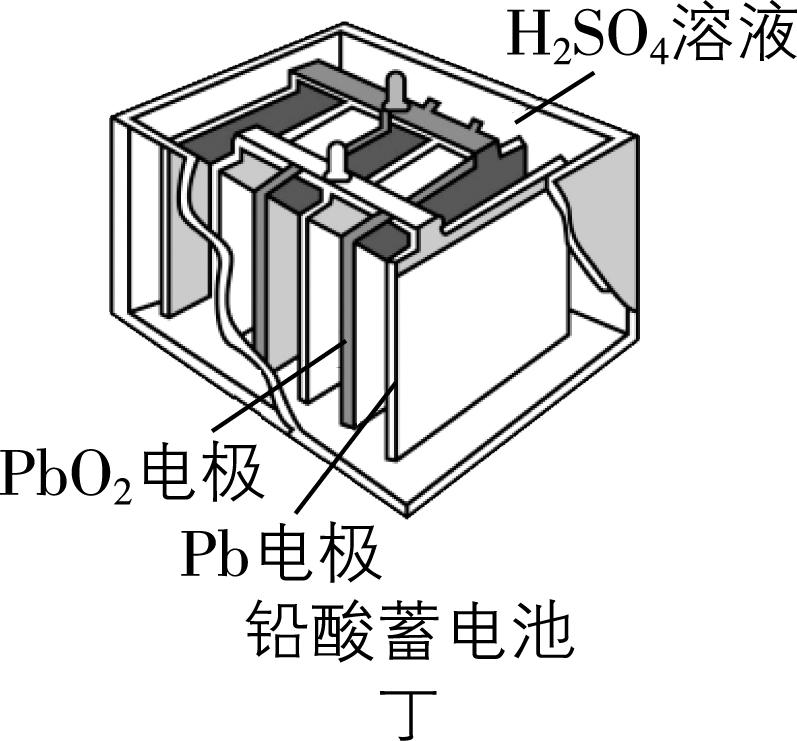
A. 甲:正极的电极反应式为 $ {\rm {\mathrm{A}\mathrm{g}}_{2}\mathrm{O}+2{\mathrm{e}}^{-}+2{\mathrm{O}\mathrm{H}}^{-}\xlongequal{}2\mathrm{A}\mathrm{g}+2{\mathrm{H}}_{2}\mathrm{O}} $
B. 乙:锌筒作负极,发生还原反应,锌筒会变薄
C. 丙:使用一段时间后,电解质溶液的酸性减弱,导电能力下降
D. 丁:放电过程中,负极质量减少,正极质量增加
答案:C
解析:图甲中锌作负极失去电子,氧化银作正极,溶液为碱性,正极的电极反应式为 $ {\rm {\mathrm{A}\mathrm{g}}_{2}\mathrm{O}+{\mathrm{H}}_{2}\mathrm{O}+2{\mathrm{e}}^{-}\xlongequal{}2\mathrm{A}\mathrm{g}+2{\mathrm{O}\mathrm{H}}^{-}} $ , $ {\rm \mathrm{A}} $ 错误;锌锰干电池中,锌作负极失去电子,被氧化,发生氧化反应, $ {\rm \mathrm{B}} $ 错误;酸性氢氧燃料电池中,正极反应式为 $ {\rm {\mathrm{O}}_{2}+4{\mathrm{H}}^{+}+4{\mathrm{e}}^{-}\xlongequal{}2{\mathrm{H}}_{2}\mathrm{O}} $ ,负极反应式为 $ {\rm 2{\mathrm{H}}_{2}-4{\mathrm{e}}^{-}\xlongequal{}4{\mathrm{H}}^{+}} $ ,虽然消耗和生成的氢离子的物质的量相同, $ {\rm n({\mathrm{H}}^{+})} $ 不变,但是产物为水,稀释了酸溶液,导致溶液酸性减弱,离子浓度减小,导电能力下降, $ {\rm \mathrm{C}} $ 正确;铅酸蓄电池放电时,正极反应式为 $ {\rm {\mathrm{P}\mathrm{b}\mathrm{O}}_{2}+4{\mathrm{H}}^{+}+{\mathrm{S}\mathrm{O}}_{4}^{2-}+2{\mathrm{e}}^{-}\xlongequal{}{\mathrm{P}\mathrm{b}\mathrm{S}\mathrm{O}}_{4}+2{\mathrm{H}}_{2}\mathrm{O}} $ ,负极反应式为 $ {\rm \mathrm{P}\mathrm{b}+{\mathrm{S}\mathrm{O}}_{4}^{2-}-2{\mathrm{e}}^{-}\xlongequal{}{\mathrm{P}\mathrm{b}\mathrm{S}\mathrm{O}}_{4}} $ ,产物硫酸铅会附着在电极上,所以放电过程中,正、负极质量均增加, $ {\rm \mathrm{D}} $ 错误。
10.如图所示,下列关于碱性乙醇燃料电池的说法不正确的是( )
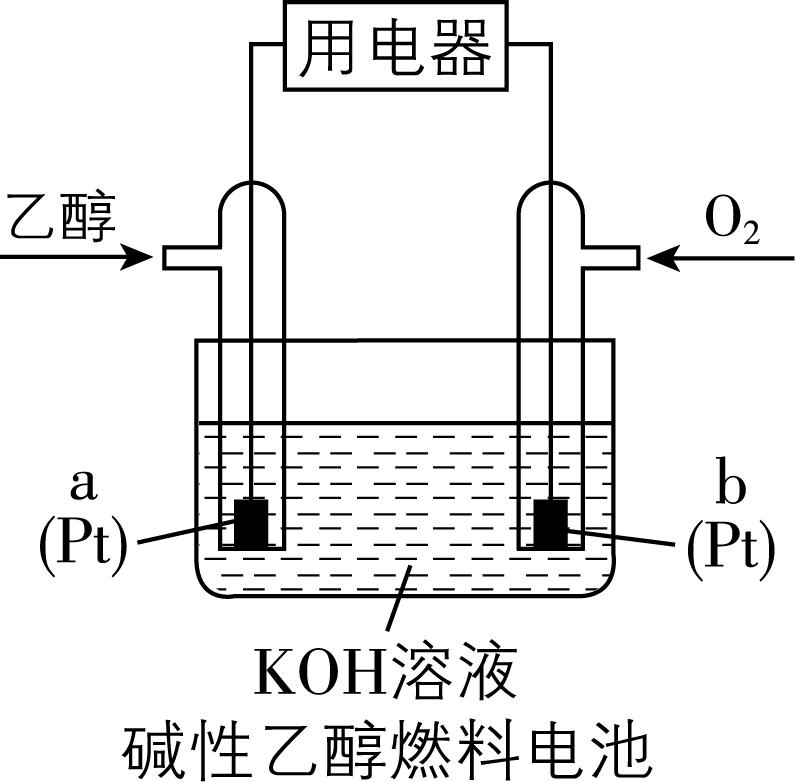
A. 电池工作结束后,电解质溶液的 $ {\rm \mathrm{p}\mathrm{H}} $ 减小
B. 电池工作时,外电路中电流从 $ \mathrm{b} $ 电极流向 $ \mathrm{a} $ 电极
C. 当 $ 0.2\mathrm{m}\mathrm{o}\mathrm{l} $ 电子通过装置时, $ \mathrm{b} $ 电极上消耗 $ {\rm 1.12\mathrm{L}} $ 氧气(标准状况)
D. 电极 $ \mathrm{a} $ 的反应式为 $ {\rm {\mathrm{C}}_{2}{\mathrm{H}}_{5}\mathrm{O}\mathrm{H}-12{\mathrm{e}}^{-}+3{\mathrm{H}}_{2}\mathrm{O}\xlongequal{}2{\mathrm{C}\mathrm{O}}_{2}+12{\mathrm{H}}^{+}} $
答案:D
解析: $ \mathrm{a} $ 极通入乙醇,乙醇失电子发生氧化反应, $ \mathrm{a} $ 是负极; $ \mathrm{b} $ 极通入氧气,氧气得电子发生还原反应, $ \mathrm{b} $ 是正极。正极发生反应: $ {\rm {\mathrm{O}}_{2}+4{\mathrm{e}}^{-}+2{\mathrm{H}}_{2}\mathrm{O}\xlongequal{}4{\mathrm{O}\mathrm{H}}^{-}} $ ,负极电极反应式为 $ {\rm {\mathrm{C}}_{2}{\mathrm{H}}_{5}\mathrm{O}\mathrm{H}-12{\mathrm{e}}^{-}+16{\mathrm{O}\mathrm{H}}^{-}\xlongequal{}2{\mathrm{C}\mathrm{O}}_{3}^{2-}+11{\mathrm{H}}_{2}\mathrm{O}} $ ,即电池工作时,消耗的 $ {\rm {\mathrm{O}\mathrm{H}}^{-}} $ 多于生成的 $ {\rm {\mathrm{O}\mathrm{H}}^{-}} $ ,电池工作结束后,电解质溶液的 $ {\rm \mathrm{p}\mathrm{H}} $ 减小, $ {\rm \mathrm{A}} $ 正确; $ \mathrm{a} $ 是负极、 $ \mathrm{b} $ 是正极,电池工作时,外电路中电流从 $ \mathrm{b} $ 电极流向 $ \mathrm{a} $ 电极, $ {\rm \mathrm{B}} $ 正确;当 $ 0.2\mathrm{m}\mathrm{o}\mathrm{l} $ 电子通过装置时, $ \mathrm{b} $ 电极上消耗 $ 0.05\mathrm{m}\mathrm{o}\mathrm{l} $ 氧气,标准状况下的体积为 $ {\rm 1.12\mathrm{L}} $ , $ {\rm \mathrm{C}} $ 正确;乙醇失电子发生氧化反应, $ \mathrm{a} $ 是负极,负极反应式为 $ {\rm {\mathrm{C}}_{2}{\mathrm{H}}_{5}\mathrm{O}\mathrm{H}-12{\mathrm{e}}^{-}+16{\mathrm{O}\mathrm{H}}^{-}\xlongequal{}2{\mathrm{C}\mathrm{O}}_{3}^{2-}+11{\mathrm{H}}_{2}\mathrm{O}} $ , $ {\rm \mathrm{D}} $ 错误。
11.原电池的电极反应不仅与电极材料的性质有关,还与电解质溶液有关。下列说法中不正确的是( )
A. 由 $ {\rm \mathrm{A}\mathrm{l}} $ 、 $ {\rm \mathrm{C}\mathrm{u}} $ 、稀硫酸组成的原电池,其负极反应式为 $ {\rm \mathrm{A}\mathrm{l}-3{\mathrm{e}}^{-}\xlongequal{}{\mathrm{A}\mathrm{l}}^{3+}} $
B. 由 $ {\rm \mathrm{M}\mathrm{g}} $ 、 $ {\rm \mathrm{A}\mathrm{l}} $ 、 $ {\rm \mathrm{N}\mathrm{a}\mathrm{O}\mathrm{H}} $ 溶液组成的原电池,其负极反应式为 $ {\rm \mathrm{A}\mathrm{l}-3{\mathrm{e}}^{-}+4{\mathrm{O}\mathrm{H}}^{-}\xlongequal{} [\mathrm{A}\mathrm{l} (\mathrm{O}\mathrm{H})_{4}{ ]}^{-}} $
C. 由 $ {\rm \mathrm{F}\mathrm{e}} $ 、 $ {\rm \mathrm{C}\mathrm{u}} $ 、 $ {\rm {\mathrm{F}\mathrm{e}\mathrm{C}\mathrm{l}}_{3}} $ 溶液组成的原电池,其负极反应式为 $ {\rm \mathrm{C}\mathrm{u}-2{\mathrm{e}}^{-}\xlongequal{}{\mathrm{C}\mathrm{u}}^{2+}} $
D. 由 $ {\rm \mathrm{A}\mathrm{l}} $ 、 $ {\rm \mathrm{C}\mathrm{u}} $ 、浓硝酸组成的原电池,其负极反应式为 $ {\rm \mathrm{C}\mathrm{u}-2{\mathrm{e}}^{-}\xlongequal{}{\mathrm{C}\mathrm{u}}^{2+}} $
答案:C
解析:由 $ {\rm \mathrm{A}\mathrm{l}} $ 、 $ {\rm \mathrm{C}\mathrm{u}} $ 、稀硫酸组成的原电池,铝作负极,其负极反应式为 $ {\rm \mathrm{A}\mathrm{l}-3{\mathrm{e}}^{-}\xlongequal{}{\mathrm{A}\mathrm{l}}^{3+}} $ , $ {\rm \mathrm{A}} $ 正确;由 $ {\rm \mathrm{M}\mathrm{g}} $ 、 $ {\rm \mathrm{A}\mathrm{l}} $ 、 $ {\rm \mathrm{N}\mathrm{a}\mathrm{O}\mathrm{H}} $ 溶液组成的原电池,铝失电子发生氧化反应,铝作负极,其负极反应式为 $ {\rm \mathrm{A}\mathrm{l}-3{\mathrm{e}}^{-}+4{\mathrm{O}\mathrm{H}}^{-}\xlongequal{} [\mathrm{A}\mathrm{l} (\mathrm{O}\mathrm{H})_{4}{ ]}^{-}} $ , $ {\rm \mathrm{B}} $ 正确;由 $ {\rm \mathrm{F}\mathrm{e}} $ 、 $ {\rm \mathrm{C}\mathrm{u}} $ 、 $ {\rm {\mathrm{F}\mathrm{e}\mathrm{C}\mathrm{l}}_{3}} $ 溶液组成的原电池,铁的还原性强于铜,铁作负极,其负极反应式为 $ {\rm \mathrm{F}\mathrm{e}-2{\mathrm{e}}^{-}\xlongequal{}{\mathrm{F}\mathrm{e}}^{2+}} $ , $ {\rm \mathrm{C}} $ 错误;由 $ {\rm \mathrm{A}\mathrm{l}} $ 、 $ {\rm \mathrm{C}\mathrm{u}} $ 、浓硝酸组成的原电池,铝在浓硝酸中钝化,铜作负极,其负极反应式为 $ {\rm \mathrm{C}\mathrm{u}-2{\mathrm{e}}^{-}\xlongequal{}{\mathrm{C}\mathrm{u}}^{2+}} $ , $ {\rm \mathrm{D}} $ 正确。
![]()
![]()
![]()



















