1.中华传统文化中蕴含着很多化学知识,下列说法错误的是( )
A. “落红不是无情物,化作春泥更护花”蕴含着自然界中的碳、氮循环
B. 《元丰行示德逢》里“雷蟠电掣云滔滔,夜半载雨输亭皋”涉及化学反应: $ {\rm {\mathrm{N}}_{2}+{\mathrm{O}}_{2}\xlongequal{放电}2\mathrm{N}\mathrm{O}} $
C. 《天工开物》中“至于矾现五色之形,硫为群石之将,皆变化于烈火”,其中“矾”指的是金属的硫酸盐
D. 《天工开物》中“凡火药,硫为纯阳,硝为纯阴”,其中硫为浓硫酸
答案:D
解析:花中含有有机物,“落红不是无情物,化作春泥更护花”蕴含着自然界中的碳、氮循环, $ {\rm \mathrm{A}} $ 正确;题给诗句中涉及氮气和氧气在放电条件下的反应: $ {\rm {\mathrm{N}}_{2}+{\mathrm{O}}_{2}\xlongequal{放电}2\mathrm{N}\mathrm{O}} $ , $ {\rm \mathrm{B}} $ 正确;该句中“矾”指的是金属的硫酸盐, $ {\rm \mathrm{C}} $ 正确;火药中的硫为硫黄, $ {\rm \mathrm{D}} $ 错误。
2.下列叙述正确的有( )
$ {\rm ①\mathrm{C}\mathrm{O}} $ 、 $ {\rm \mathrm{N}\mathrm{O}} $ 、 $ {\rm {\mathrm{N}\mathrm{O}}_{2}} $ 都是大气污染物,都能在空气中稳定存在 ②常温下,可用铁制容器盛装浓硝酸或浓硫酸,是因为铁在常温下与浓硝酸、浓硫酸不反应 $ {\rm ③{\mathrm{N}}_{2}} $ 性质稳定,工业生产金属镁时,为防止 $ {\rm \mathrm{M}\mathrm{g}} $ 被氧化,可以用 $ {\rm {\mathrm{N}}_{2}} $ 作保护气
④敞口放置的浓硝酸和浓硫酸,浓度均会变低
⑤氨气极易溶于水,故可用作制冷剂 ⑥通过豆科植物的根瘤菌将氮气转化为含氮化合物,是自然固氮的途径之一
A. ①②③④
B. ②③④⑥
C. ③④⑤⑥
D. ④⑥
答案:D
解析: $ {\rm \mathrm{C}\mathrm{O}} $ 、 $ {\rm \mathrm{N}\mathrm{O}} $ 、 $ {\rm {\mathrm{N}\mathrm{O}}_{2}} $ 都是大气污染物, $ {\rm \mathrm{N}\mathrm{O}} $ 易与空气中的氧气反应,不能在空气中稳定存在,①错误;常温下,铁遇浓硫酸或浓硝酸会钝化,在铁的表面生成一层致密的薄膜,阻止内部金属继续反应,所以可以用铁制容器盛装浓硝酸或浓硫酸,②错误; $ {\rm {\mathrm{N}}_{2}} $ 性质稳定,但镁能在氮气中燃烧生成氮化镁,工业生产金属镁时,不能用 $ {\rm {\mathrm{N}}_{2}} $ 作保护气,③错误;浓硫酸具有吸水性,敞口放置的浓硫酸因吸收空气中的 $ {\rm {\mathrm{H}}_{2}\mathrm{O}} $ ,浓度会变低,浓硝酸具有挥发性、不稳定性,敞口放置的浓硝酸浓度会变低,④正确; $ {\rm {\mathrm{N}\mathrm{H}}_{3}} $ 常温下呈气态,液氨易汽化,且汽化时吸热,故可用作制冷剂,与氨气极易溶于水无关,⑤错误;氮的固定是指将游离态的氮转化为化合态的氮,豆科植物的根瘤菌可以将游离态的氮气转化为含氮化合物,是自然固氮的途径之一,⑥正确;综上,④⑥正确,故选 $ {\rm \mathrm{D}} $ 。
3.光催化固氮被认为是一种极具前景的人工固氮技术,光照条件下,在催化剂表面进行固氮反应的两种途径如图所示,下列说法错误的是( )
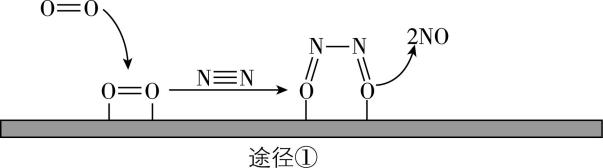
A. 将大气中游离态的氮转化为氮的化合物的过程叫作氮的固定
B. 途径②中, $ {\rm {\mathrm{N}}_{2}} $ 发生了氧化反应
C. 选择合适的催化剂,可以使 $ {\rm {\mathrm{N}}_{2}} $ 与 $ {\rm {\mathrm{O}}_{2}} $ 一步化合生成 $ {\rm {\mathrm{N}\mathrm{O}}_{2}} $
D. 在常温下, $ {\rm \mathrm{N}\mathrm{O}} $ 是不溶于水的共价化合物
答案:C
解析:将大气中游离态的氮转化为氮的化合物的过程叫作氮的固定, $ {\rm \mathrm{A}} $ 正确;由题图可知,途径②中, $ {\rm {\mathrm{N}}_{2}} $ 转化成 $ {\rm \mathrm{N}\mathrm{O}} $ ,发生了氧化反应, $ {\rm \mathrm{B}} $ 正确; $ {\rm {\mathrm{N}}_{2}} $ 与 $ {\rm {\mathrm{O}}_{2}} $ 化合只能生成 $ {\rm \mathrm{N}\mathrm{O}} $ ,不可直接生成 $ {\rm {\mathrm{N}\mathrm{O}}_{2}} $ , $ {\rm \mathrm{C}} $ 错误;在常温下, $ {\rm \mathrm{N}\mathrm{O}} $ 中只有共价键,是共价化合物,且不溶于水, $ {\rm \mathrm{D}} $ 正确。
4.合成氨及其衍生物工业是化工生产的重要门类,请结合图示判断下列说法正确的是( )
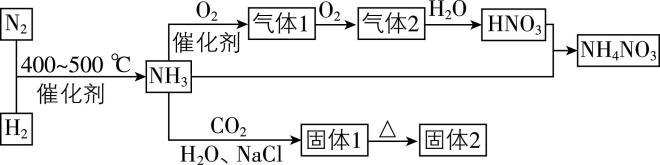
A. 气体2是 $ {\rm \mathrm{N}\mathrm{O}} $ ,属于酸性氧化物
B. 硝酸铵可作为氮肥,与草木灰共用可提高肥效
C. 饱和 $ {\rm \mathrm{N}\mathrm{a}\mathrm{C}\mathrm{l}} $ 溶液中先通入过量 $ {\rm {\mathrm{N}\mathrm{H}}_{3}} $ 再通入过量 $ {\rm {\mathrm{C}\mathrm{O}}_{2}} $ 可以得到固体1
D. $ {\rm 1\mathrm{L}} $ 气体1、2的混合气与 $ {\rm 1\mathrm{L}{\mathrm{N}\mathrm{H}}_{3}} $ 在一定条件下转化为对环境无害的物质,混合气中气体1和气体2的体积比为 $ 1:2 $
答案:C
解析:由分析知,气体2为 $ {\rm {\mathrm{N}\mathrm{O}}_{2}} $ ,属于不成盐氧化物, $ {\rm \mathrm{A}} $ 错误;硝酸铵与草木灰(含 $ {\rm {\mathrm{K}}_{2}{\mathrm{C}\mathrm{O}}_{3}} $ ,水解显碱性)混用, $ {\rm {\mathrm{N}\mathrm{H}}_{4}^{+}} $ 与 $ {\rm {\mathrm{O}\mathrm{H}}^{-}} $ 反应生成 $ {\rm {\mathrm{N}\mathrm{H}}_{3}} $ ,降低肥效, $ {\rm \mathrm{B}} $ 错误;由于 $ {\rm {\mathrm{N}\mathrm{H}}_{3}} $ 极易溶于水,故饱和 $ {\rm \mathrm{N}\mathrm{a}\mathrm{C}\mathrm{l}} $ 溶液中先通 $ {\rm {\mathrm{N}\mathrm{H}}_{3}} $ (碱性)再通 $ {\rm {\mathrm{C}\mathrm{O}}_{2}} $ ,可生成 $ {\rm {\mathrm{N}\mathrm{a}\mathrm{H}\mathrm{C}\mathrm{O}}_{3}} $ (固体1), $ {\rm \mathrm{C}} $ 正确;氨气具有一定还原性, $ {\rm 1\mathrm{L}\mathrm{N}\mathrm{O}} $ 、 $ {\rm {\mathrm{N}\mathrm{O}}_{2}} $ 的混合气与 $ {\rm 1\mathrm{L}} $ 氨气在一定条件下转化为对环境无害的物质,化学方程式为 $ {\rm 2{\mathrm{N}\mathrm{H}}_{3}+\mathrm{N}\mathrm{O}+{\mathrm{N}\mathrm{O}}_{2}\xlongequal{一定条件}2{\mathrm{N}}_{2}+3{\mathrm{H}}_{2}\mathrm{O}} $ ,反应中 $ {\rm \mathrm{N}\mathrm{O}} $ 、 $ {\rm {\mathrm{N}\mathrm{O}}_{2}} $ 的体积比等于化学计量数之比,为 $ 1:1 $ , $ {\rm \mathrm{D}} $ 错误。
5. $ {\rm {\mathrm{N}\mathrm{H}}_{3}} $ 可用作脱硝剂。某科研小组为了探究 $ {\rm {\mathrm{N}\mathrm{O}}_{2}} $ 能否被 $ {\rm {\mathrm{N}\mathrm{H}}_{3}} $ 还原,设计的装置如图所示(夹持、加热装置已略去, $ {\rm {\mathrm{K}}_{1}} $ 、 $ {\rm {\mathrm{K}}_{2}} $ 为止水夹),下列说法不正确的是( )
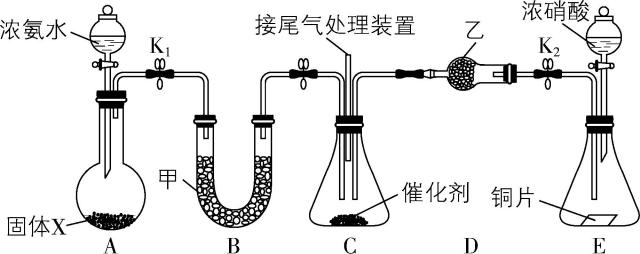
A. 固体 $ {\rm \mathrm{X}} $ 可以是碱石灰
B. 甲、乙试剂均可以是无水氯化钙
C. 实验时宜先通入 $ {\rm {\mathrm{N}\mathrm{O}}_{2}} $ ,再通入 $ {\rm {\mathrm{N}\mathrm{H}}_{3}} $ ,有利于减少空气对实验的干扰
D. 装置C的反应中 $ n $ (还原剂) $ :n $ (氧化剂) $ =4:3 $
答案:B
解析:装置 $ {\rm \mathrm{A}} $ 中浓氨水与碱石灰(或氧化钙)反应制备氨气,装置 $ {\rm \mathrm{B}} $ 中盛有的碱石灰用于干燥氨气;装置 $ {\rm \mathrm{E}} $ 中浓硝酸与铜反应制备二氧化氮,装置 $ {\rm \mathrm{D}} $ 中盛有的五氧化二磷或硅胶用于干燥二氧化氮,装置 $ {\rm \mathrm{C}} $ 中氨气与二氧化氮在催化剂作用下反应生成氮气和水。固体 $ {\rm \mathrm{X}} $ 为碱石灰、氧化钙或氢氧化钠固体均可, $ {\rm \mathrm{A}} $ 正确;氨气会和无水氯化钙反应生成氨合物,因此甲试剂不能为无水氯化钙, $ {\rm \mathrm{B}} $ 错误;二氧化氮的密度比空气大,所以实验时先通入二氧化氮排尽装置中的空气,有利于氨气充分与二氧化氮反应,减少空气对实验的干扰, $ {\rm \mathrm{C}} $ 正确;装置 $ {\rm \mathrm{C}} $ 中反应为 $ {\rm 8{\mathrm{N}\mathrm{H}}_{3}+6{\mathrm{N}\mathrm{O}}_{2}\xlongequal{催化剂}7{\mathrm{N}}_{2}+12{\mathrm{H}}_{2}\mathrm{O}} $ ,还原剂 $ {\rm ({\mathrm{N}\mathrm{H}}_{3})} $ 与氧化剂 $ {\rm ({\mathrm{N}\mathrm{O}}_{2})} $ 的物质的量之比为 $ 4:3 $ , $ {\rm \mathrm{D}} $ 正确。
6.硝酸厂烟气中的大量氮氧化物 $ {\rm ({\mathrm{N}\mathrm{O}}_{x})} $ 排放到空气中会污染空气,用还原法可以将 $ {\rm {\mathrm{N}\mathrm{O}}_{x}} $ 转化为无害物质。常温下,将 $ {\rm {\mathrm{N}\mathrm{O}}_{2}} $ 与 $ {\rm {\mathrm{H}}_{2}} $ 的混合气体通入 $ {\rm \mathrm{C}\mathrm{e}({\mathrm{S}\mathrm{O}}_{4})_{2}} $ 与 $ {\rm {\mathrm{C}\mathrm{e}}_{2}({\mathrm{S}\mathrm{O}}_{4})_{3}} $ 的混合溶液中,转化过程如图所示。下列说法错误的是( )
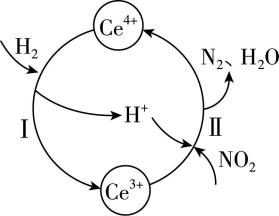
A. 总反应为 $ {\rm 2{\mathrm{N}\mathrm{O}}_{2}+4{\mathrm{H}}_{2}\xlongequal{{\mathrm{C}\mathrm{e}}^{4+}}{\mathrm{N}}_{2}+4{\mathrm{H}}_{2}\mathrm{O}} $
B. 反应Ⅱ中氧化剂与还原剂的物质的量之比为 $ 1:4 $
C. 反应一段时间后,溶液的酸性增强
D. 反应过程中,混合溶液中 $ {\rm {\mathrm{C}\mathrm{e}}^{3+}} $ 和 $ {\rm {\mathrm{C}\mathrm{e}}^{4+}} $ 的总数一定保持不变
答案:C
解析:根据思路导引可知, $ {\rm \mathrm{A}} $ 正确;反应Ⅱ中氧化剂为 $ {\rm {\mathrm{N}\mathrm{O}}_{2}} $ ,还原剂为 $ {\rm {\mathrm{C}\mathrm{e}}^{3+}} $ ,二者的物质的量之比为 $ 2:8=1:4 $ , $ {\rm \mathrm{B}} $ 正确;反应过程中生成 $ {\rm {\mathrm{H}}_{2}\mathrm{O}} $ ,故溶液酸性减弱, $ {\rm \mathrm{C}} $ 错误;反应过程中, $ {\rm {\mathrm{C}\mathrm{e}}^{4+}} $ 是反应的催化剂, $ {\rm {\mathrm{C}\mathrm{e}}^{3+}} $ 是反应的中间产物,根据元素守恒知,混合溶液中 $ {\rm {\mathrm{C}\mathrm{e}}^{3+}} $ 和 $ {\rm {\mathrm{C}\mathrm{e}}^{4+}} $ 的总数一定保持不变, $ {\rm \mathrm{D}} $ 正确。
7.实验小组用如下流程探究含氮化合物的转化。 $ {\rm {N}_{\mathrm{A}}} $ 为阿伏加德罗常数的值,下列说法正确的是( )
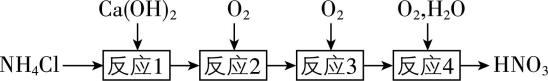
A. “反应1”中,消耗 $ {\rm 0.15\mathrm{m}\mathrm{o}\mathrm{l}{\mathrm{N}\mathrm{H}}_{4}\mathrm{C}\mathrm{l}} $ ,在 $ 25℃ $ 、 $ {\rm 101\mathrm{k}\mathrm{P}\mathrm{a}} $ 下得到 $ {\rm 3.36\mathrm{L}{\mathrm{N}\mathrm{H}}_{3}} $
B. “反应2”中,产生 $ {\rm 0.1\mathrm{m}\mathrm{o}\mathrm{l}\mathrm{N}\mathrm{O}} $ ,转移电子数为 $ {\rm 0.1{N}_{\mathrm{A}}} $
C. “反应4”中, $ {\rm 0.1\mathrm{m}\mathrm{o}\mathrm{l}{\mathrm{N}\mathrm{O}}_{2}} $ 完全转化成 $ {\rm {\mathrm{H}\mathrm{N}\mathrm{O}}_{3}} $ ,至少需要 $ {\rm 0.075\mathrm{m}\mathrm{o}\mathrm{l}{\mathrm{O}}_{2}} $
D. 产生 $ {\rm 0.5\mathrm{m}\mathrm{o}\mathrm{l}{\mathrm{H}\mathrm{N}\mathrm{O}}_{3}} $ ,理论消耗 $ {\rm \mathrm{C}\mathrm{a}(\mathrm{O}\mathrm{H})_{2}} $ 的物质的量为 $ 0.25\mathrm{m}\mathrm{o}\mathrm{l} $
答案:D
解析: $ 25℃ $ 、 $ {\rm 101\mathrm{k}\mathrm{P}\mathrm{a}} $ 不是标准状况,不能用 $ {\rm {V}_{\mathrm{m}}=22.4\mathrm{L}\cdot {\mathrm{m}\mathrm{o}\mathrm{l}}^{-1}} $ 计算氨气体积, $ {\rm \mathrm{A}} $ 错误;反应2方程式为 $ {\rm\hspace{-0.5em} \begin{array} {l} \rm 4{\mathrm{N}\mathrm{H}}_{3}+5{\mathrm{O}}_{2}\hspace{-0.5em} \begin{array}{c}{催化剂}\\ \overline{\overline{△}}\end{array} \hspace{-0.5em}4\mathrm{N}\mathrm{O}+6{\mathrm{H}}_{2}\mathrm{O}\end{array} \hspace{-0.5em} } $ ,氮元素化合价由 $ -3 $ 价升高到 $ +2 $ 价,产生 $ {\rm 0.1\mathrm{m}\mathrm{o}\mathrm{l}\mathrm{N}\mathrm{O}} $ ,转移电子数为 $ {\rm 0.5{N}_{\mathrm{A}}} $ , $ {\rm \mathrm{B}} $ 错误;根据 $ {\rm 4{\mathrm{N}\mathrm{O}}_{2}+2{\mathrm{H}}_{2}\mathrm{O}+{\mathrm{O}}_{2}\xlongequal{}4{\mathrm{H}\mathrm{N}\mathrm{O}}_{3}} $ , $ {\rm 0.1\mathrm{m}\mathrm{o}\mathrm{l}{\mathrm{N}\mathrm{O}}_{2}} $ 完全转化成 $ {\rm {\mathrm{H}\mathrm{N}\mathrm{O}}_{3}} $ ,至少需要 $ {\rm 0.025\mathrm{m}\mathrm{o}\mathrm{l}{\mathrm{O}}_{2}} $ , $ {\rm \mathrm{C}} $ 错误;根据关系式 $ {\rm \mathrm{C}\mathrm{a}(\mathrm{O}\mathrm{H})_{2}~2{\mathrm{N}\mathrm{H}}_{3}~2\mathrm{N}\mathrm{O}~2{\mathrm{N}\mathrm{O}}_{2}~2{\mathrm{H}\mathrm{N}\mathrm{O}}_{3}} $ ,产生 $ {\rm 0.5\mathrm{m}\mathrm{o}\mathrm{l}{\mathrm{H}\mathrm{N}\mathrm{O}}_{3}} $ ,理论消耗 $ {\rm \mathrm{C}\mathrm{a}(\mathrm{O}\mathrm{H})_{2}} $ 的物质的量为 $ 0.25\mathrm{m}\mathrm{o}\mathrm{l} $ , $ {\rm \mathrm{D}} $ 正确。
8.氮氧化物 $ {\rm ({\mathrm{N}\mathrm{O}}_{x})} $ 是大气污染物之一,处理工业废气中的 $ {\rm {\mathrm{N}\mathrm{O}}_{x}} $ 对于环境保护具有重要的意义。
(1) 在一定条件下 $ {\rm {\mathrm{N}\mathrm{H}}_{3}} $ 可将 $ {\rm {\mathrm{N}\mathrm{O}}_{2}} $ 还原。甲同学在实验室对该反应进行了探究。实验设计如图甲(部分夹持装置省略):
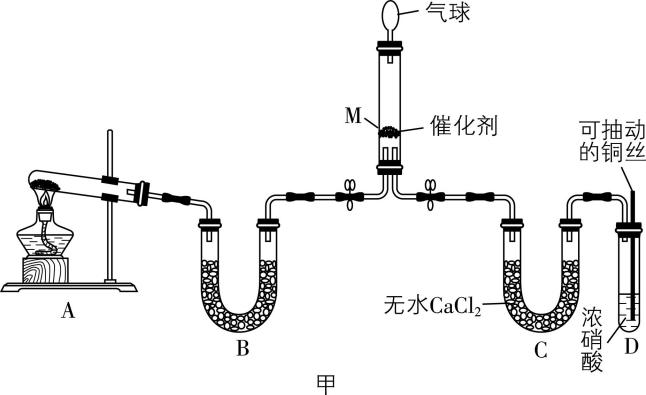
① 用装置A制备 $ {\rm {\mathrm{N}\mathrm{H}}_{3}} $ ,其中发生反应的化学方程式为 ;装置B内的试剂是 。
② 装置D中发生反应的离子方程式是 。
(2) 用 $ {\rm \mathrm{N}\mathrm{a}\mathrm{O}\mathrm{H}} $ 溶液吸收法处理 $ {\rm {\mathrm{N}\mathrm{O}}_{x}} $ (仅含 $ {\rm \mathrm{N}\mathrm{O}} $ 、 $ {\rm {\mathrm{N}\mathrm{O}}_{2}} $ )。已知过程中发生的反应有 $ {\rm 2\mathrm{N}\mathrm{a}\mathrm{O}\mathrm{H}+\mathrm{N}\mathrm{O}+{\mathrm{N}\mathrm{O}}_{2}\xlongequal{}2{\mathrm{N}\mathrm{a}\mathrm{N}\mathrm{O}}_{2}+{\mathrm{H}}_{2}\mathrm{O}} $ , $ {\rm 2\mathrm{N}\mathrm{a}\mathrm{O}\mathrm{H}+2{\mathrm{N}\mathrm{O}}_{2}\xlongequal{}{\mathrm{N}\mathrm{a}\mathrm{N}\mathrm{O}}_{3}+{\mathrm{N}\mathrm{a}\mathrm{N}\mathrm{O}}_{2}+{\mathrm{H}}_{2}\mathrm{O}} $ 。
① 用不同浓度的 $ {\rm \mathrm{N}\mathrm{a}\mathrm{O}\mathrm{H}} $ 溶液吸收 $ {\rm {\mathrm{N}\mathrm{O}}_{2}} $ 含量不同的尾气,关系如图乙所示:
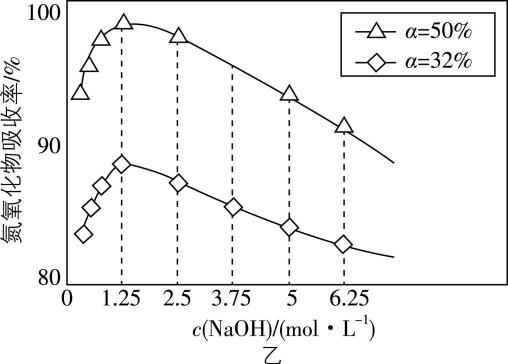
$ \alpha $ 表示 $ {\rm {\mathrm{N}\mathrm{O}}_{x}} $ 中 $ {\rm {\mathrm{N}\mathrm{O}}_{2}} $ 的含量,用 $ {\rm \mathrm{N}\mathrm{a}\mathrm{O}\mathrm{H}} $ 溶液吸收氮氧化物的最佳条件为 $ \alpha = $ 、 $ {\rm c(\mathrm{N}\mathrm{a}\mathrm{O}\mathrm{H})=} $ 。
② 若一定体积的 $ {\rm {\mathrm{N}\mathrm{O}}_{x}} $ 被 $ {\rm 250\mathrm{m}\mathrm{L}2\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}} $ 的 $ {\rm \mathrm{N}\mathrm{a}\mathrm{O}\mathrm{H}} $ 溶液恰好完全吸收,溶液质量增加 $ 19.8\mathrm{g} $ ,则 $ x $ 的值为 。
(3) $ {\rm \mathrm{N}\mathrm{O}} $ 的氧化吸收。用 $ {\rm \mathrm{N}\mathrm{a}\mathrm{C}\mathrm{l}\mathrm{O}} $ 溶液吸收尾气,可提高尾气中 $ {\rm \mathrm{N}\mathrm{O}} $ 的去除率。其他条件相同, $ {\rm \mathrm{N}\mathrm{O}} $ 转化为 $ {\rm {\mathrm{N}\mathrm{O}}_{3}^{-}} $ 的转化率随 $ {\rm \mathrm{N}\mathrm{a}\mathrm{C}\mathrm{l}\mathrm{O}} $ 溶液初始 $ {\rm \mathrm{p}\mathrm{H}} $ (用稀盐酸调节)的变化如图丙所示。
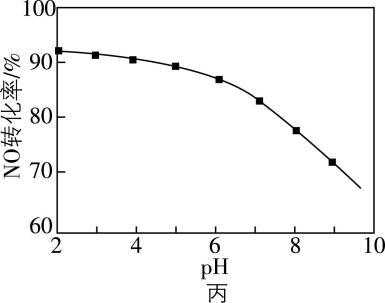
① 在酸性溶液中, $ {\rm \mathrm{H}\mathrm{C}\mathrm{l}\mathrm{O}} $ 氧化 $ {\rm \mathrm{N}\mathrm{O}} $ 生成 $ {\rm {\mathrm{C}\mathrm{l}}^{-}} $ 和 $ {\rm {\mathrm{N}\mathrm{O}}_{3}^{-}} $ ,其离子方程式为 ;
② $ {\rm \mathrm{N}\mathrm{a}\mathrm{C}\mathrm{l}\mathrm{O}} $ 溶液的初始 $ {\rm \mathrm{p}\mathrm{H}} $ 越小, $ {\rm \mathrm{N}\mathrm{O}} $ 转化率越高,其原因是 。
答案:① $ {\rm 2{\mathrm{N}\mathrm{H}}_{4}\mathrm{C}\mathrm{l}+\mathrm{C}\mathrm{a}(\mathrm{O}\mathrm{H})_{2}\xlongequal{△}{\mathrm{C}\mathrm{a}\mathrm{C}\mathrm{l}}_{2}+2{\mathrm{N}\mathrm{H}}_{3}↑+2{\mathrm{H}}_{2}\mathrm{O}} $ ;碱石灰
② $ {\rm \mathrm{C}\mathrm{u}+4{\mathrm{H}}^{+}+2{\mathrm{N}\mathrm{O}}_{3}^{-}\xlongequal{}{\mathrm{C}\mathrm{u}}^{2+}+2{\mathrm{N}\mathrm{O}}_{2}↑+2{\mathrm{H}}_{2}\mathrm{O}} $
(2) ① $ 50\% $ ; $ {\rm 1.25\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}} $
② 1.6
(3) ① $ {\rm 3\mathrm{H}\mathrm{C}\mathrm{l}\mathrm{O}+2\mathrm{N}\mathrm{O}+{\mathrm{H}}_{2}\mathrm{O}\xlongequal{}3{\mathrm{C}\mathrm{l}}^{-}+2{\mathrm{N}\mathrm{O}}_{3}^{-}+5{\mathrm{H}}^{+}} $
② 次氯酸根离子和氢离子转化为氧化性强的 $ {\rm \mathrm{H}\mathrm{C}\mathrm{l}\mathrm{O}} $ , $ {\rm \mathrm{N}\mathrm{a}\mathrm{C}\mathrm{l}\mathrm{O}} $ 溶液的初始 $ {\rm \mathrm{p}\mathrm{H}} $ 越小,氢离子浓度越大,反应生成的 $ {\rm \mathrm{H}\mathrm{C}\mathrm{l}\mathrm{O}} $ 越多, $ {\rm \mathrm{N}\mathrm{O}} $ 转化率越高
【图解】

解析:① 由分析知,用装置 $ {\rm \mathrm{A}} $ 制备 $ {\rm {\mathrm{N}\mathrm{H}}_{3}} $ 的化学方程式为 $ {\rm 2{\mathrm{N}\mathrm{H}}_{4}\mathrm{C}\mathrm{l}+\mathrm{C}\mathrm{a}(\mathrm{O}\mathrm{H})_{2}\xlongequal{△}{\mathrm{C}\mathrm{a}\mathrm{C}\mathrm{l}}_{2}+2{\mathrm{N}\mathrm{H}}_{3}↑+2{\mathrm{H}}_{2}\mathrm{O}} $ ;装置 $ {\rm \mathrm{B}} $ 的作用是干燥氨气, $ {\rm \mathrm{U}} $ 形管内的试剂是碱石灰。
② 装置 $ {\rm \mathrm{D}} $ 中铜与浓硝酸反应生成硝酸铜、二氧化氮与水,离子方程式是 $ {\rm \mathrm{C}\mathrm{u}+4{\mathrm{H}}^{+}+2{\mathrm{N}\mathrm{O}}_{3}^{-}\xlongequal{}{\mathrm{C}\mathrm{u}}^{2+}+2{\mathrm{N}\mathrm{O}}_{2}↑+2{\mathrm{H}}_{2}\mathrm{O}} $ 。
(2) ① 根据图像分析可知, $ \alpha =50\% $ 、 $ {\rm c(\mathrm{N}\mathrm{a}\mathrm{O}\mathrm{H})=1.25\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}} $ 时,氮氧化物的吸收率最高。
② 若一定体积的 $ {\rm {\mathrm{N}\mathrm{O}}_{x}} $ 被 $ {\rm 250\mathrm{m}\mathrm{L}2\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}} $ 的 $ {\rm \mathrm{N}\mathrm{a}\mathrm{O}\mathrm{H}} $ 溶液(含 $ {\rm 0.5\mathrm{m}\mathrm{o}\mathrm{l}\mathrm{N}\mathrm{a}\mathrm{O}\mathrm{H}} $ )恰好完全吸收,溶液质量增加 $ 19.8\mathrm{g} $ ,结合质量守恒知 $ {\rm {\mathrm{N}\mathrm{O}}_{x}} $ 质量为 $ 19.8\mathrm{g} $ ,结合方程式可知, $ {\rm n(\mathrm{N}):n(\mathrm{N}\mathrm{a})=1:1} $ ,则 $ {\rm {\mathrm{N}\mathrm{O}}_{x}} $ 物质的量为 $ 0.5\mathrm{m}\mathrm{o}\mathrm{l} $ , $ \dfrac{19.8\mathrm{g}}{0.5\mathrm{m}\mathrm{o}\mathrm{l}}=(14+16x)\mathrm{g}\cdot {\mathrm{m}\mathrm{o}\mathrm{l}}^{-1} $ ,解得 $ x=1.6 $ 。
(3) ① 在酸性溶液中, $ {\rm \mathrm{H}\mathrm{C}\mathrm{l}\mathrm{O}} $ 氧化 $ {\rm \mathrm{N}\mathrm{O}} $ 生成 $ {\rm {\mathrm{C}\mathrm{l}}^{-}} $ 和 $ {\rm {\mathrm{N}\mathrm{O}}_{3}^{-}} $ ,反应中 $ {\rm \mathrm{C}\mathrm{l}} $ 化合价由 $ +1 $ 变为 $ -1 $ 、 $ {\rm \mathrm{N}} $ 化合价由 $ +2 $ 变为 $ +5 $ ,结合得失电子守恒、原子守恒、电荷守恒可得离子方程式为 $ {\rm 3\mathrm{H}\mathrm{C}\mathrm{l}\mathrm{O}+2\mathrm{N}\mathrm{O}+{\mathrm{H}}_{2}\mathrm{O}\xlongequal{}3{\mathrm{C}\mathrm{l}}^{-}+2{\mathrm{N}\mathrm{O}}_{3}^{-}+5{\mathrm{H}}^{+}} $ 。
② 次氯酸根离子和氢离子转化为氧化性强的 $ {\rm \mathrm{H}\mathrm{C}\mathrm{l}\mathrm{O}} $ , $ {\rm \mathrm{N}\mathrm{a}\mathrm{C}\mathrm{l}\mathrm{O}} $ 溶液的初始 $ {\rm \mathrm{p}\mathrm{H}} $ 越小,氢离子浓度越大,使得溶液中 $ {\rm \mathrm{H}\mathrm{C}\mathrm{l}\mathrm{O}} $ 浓度越大, $ {\rm \mathrm{N}\mathrm{O}} $ 转化率越高。









