课时4 酸雨及其防治
一、刷基础
1. $ {\rm {\mathrm{S}\mathrm{O}}_{2}} $ 属于严重的大气污染物,可用 $ {\rm {\mathrm{H}}_{2}} $ 与 $ {\rm {\mathrm{S}\mathrm{O}}_{2}} $ 高温反应消除 $ {\rm {\mathrm{S}\mathrm{O}}_{2}} $ 的污染,其反应原理可分为两步,过程如图所示。下列说法正确的是( )
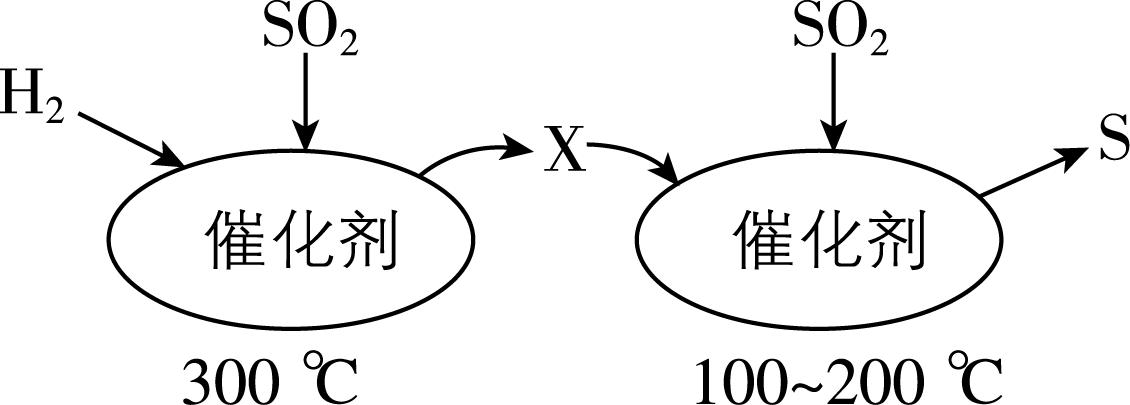
A. $ {\rm \mathrm{X}} $ 中 $ {\rm \mathrm{S}} $ 元素的化合价为0价
B. 大气中的 $ {\rm {\mathrm{S}\mathrm{O}}_{2}} $ 必须氧化成 $ {\rm {\mathrm{S}\mathrm{O}}_{3}} $ 才能形成酸雨
C. 在 $ 100\sim 200℃ $ 温度时发生的是置换反应
D. 工业上可用氢氧化钠溶液处理工业尾气中的 $ {\rm {\mathrm{S}\mathrm{O}}_{2}} $
答案:D
解析:根据反应原理, $ 300℃ $ 时 $ {\rm {\mathrm{H}}_{2}} $ 和 $ {\rm {\mathrm{S}\mathrm{O}}_{2}} $ 反应生成 $ {\rm \mathrm{X}} $ , $ {\rm \mathrm{X}} $ 又在 $ 100~200℃ $ 和 $ {\rm {\mathrm{S}\mathrm{O}}_{2}} $ 反应生成 $ {\rm \mathrm{S}} $ ,结合氧化还原反应中元素化合价变化规律,可知 $ {\rm \mathrm{X}} $ 为 $ {\rm {\mathrm{H}}_{2}\mathrm{S}} $ , $ {\rm \mathrm{A}} $ 错误; $ {\rm {\mathrm{S}\mathrm{O}}_{2}} $ 可以和水反应生成 $ {\rm {\mathrm{H}}_{2}{\mathrm{S}\mathrm{O}}_{3}} $ , $ {\rm {\mathrm{H}}_{2}{\mathrm{S}\mathrm{O}}_{3}} $ 再被氧气氧化为 $ {\rm {\mathrm{H}}_{2}{\mathrm{S}\mathrm{O}}_{4}} $ ,也形成酸雨, $ {\rm \mathrm{B}} $ 错误;由 $ {\rm \mathrm{A}} $ 项分析知,在 $ 100~200℃ $ 温度时 $ {\rm {\mathrm{S}\mathrm{O}}_{2}} $ 和 $ {\rm {\mathrm{H}}_{2}\mathrm{S}} $ 发生反应: $ {\rm 2{\mathrm{H}}_{2}\mathrm{S}+{\mathrm{S}\mathrm{O}}_{2}\xlongequal{}3\mathrm{S}+2{\mathrm{H}}_{2}\mathrm{O}} $ ,不属于置换反应, $ {\rm \mathrm{C}} $ 错误; $ {\rm {\mathrm{S}\mathrm{O}}_{2}} $ 是酸性氧化物,工业上可以用氢氧化钠溶液处理工业尾气中的 $ {\rm {\mathrm{S}\mathrm{O}}_{2}} $ , $ {\rm \mathrm{D}} $ 正确。
2.燃油汽车行驶中会产生 $ {\rm \mathrm{C}\mathrm{O}} $ 、 $ {\rm \mathrm{N}\mathrm{O}} $ 等多种污染物。如图所示为汽车发动机和催化转化器中发生的部分化学反应。下列说法不正确的是( )
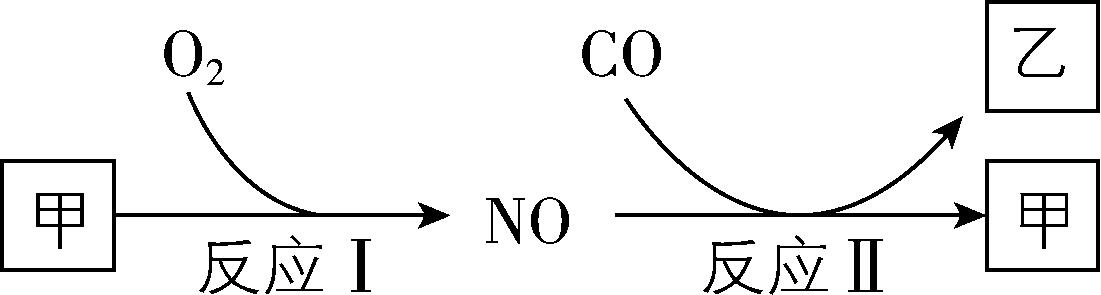
A. 反应Ⅰ是在高温条件下发生的
B. 反应Ⅱ属于人工固氮
C. 物质甲可以和镁反应生成 $ {\rm {\mathrm{A}}_{3}{\mathrm{B}}_{2}} $ 型化合物
D. 物质乙和氨气可以合成尿素 $ {\rm [\mathrm{C}\mathrm{O} ({\mathrm{N}\mathrm{H}}_{2})_{2} ]} $
答案:B
解析:甲和 $ {\rm {\mathrm{O}}_{2}} $ 反应生成 $ {\rm \mathrm{N}\mathrm{O}} $ ,则甲含有 $ {\rm \mathrm{N}} $ 元素; $ {\rm \mathrm{N}\mathrm{O}} $ 和 $ {\rm \mathrm{C}\mathrm{O}} $ 反应生成 $ {\rm {\mathrm{N}}_{2}} $ 和 $ {\rm {\mathrm{C}\mathrm{O}}_{2}} $ ,则甲是 $ {\rm {\mathrm{N}}_{2}} $ 、乙是 $ {\rm {\mathrm{C}\mathrm{O}}_{2}} $ 。 $ {\rm {\mathrm{N}}_{2}} $ 和 $ {\rm {\mathrm{O}}_{2}} $ 在高温条件下反应生成 $ {\rm \mathrm{N}\mathrm{O}} $ , $ {\rm \mathrm{A}} $ 正确;反应Ⅱ是 $ {\rm \mathrm{N}\mathrm{O}} $ 和 $ {\rm \mathrm{C}\mathrm{O}} $ 反应生成 $ {\rm {\mathrm{N}}_{2}} $ 和 $ {\rm {\mathrm{C}\mathrm{O}}_{2}} $ ,氮的固定是 $ {\rm \mathrm{N}} $ 从游离态变为化合态,所以反应Ⅱ不属于人工固氮, $ {\rm \mathrm{B}} $ 错误; $ {\rm {\mathrm{N}}_{2}} $ 可以和镁反应生成 $ {\rm {\mathrm{M}\mathrm{g}}_{3}{\mathrm{N}}_{2}} $ , $ {\rm \mathrm{C}} $ 正确; $ {\rm {\mathrm{C}\mathrm{O}}_{2}} $ 可以和 $ {\rm {\mathrm{N}\mathrm{H}}_{3}} $ 反应生成尿素 $ {\rm [\mathrm{C}\mathrm{O} ({\mathrm{N}\mathrm{H}}_{2})_{2} ]} $ 和水, $ {\rm \mathrm{D}} $ 正确。
3.防治污染,改善生态环境已成为全球共识。回答下列问题:
(1) 下列物质会形成酸雨的是 (填序号)。
A.碳氧化物 B.硫氧化物 C.氮氧化物
(2) 汽车尾气处理通常是在汽车排气管上安装催化转化器,将其中的有害气体 $ {\rm \mathrm{N}\mathrm{O}} $ 、 $ {\rm \mathrm{C}\mathrm{O}} $ 转化为无害气体,反应的化学方程式为 。
(3) 工业上可利用反应 $ {\rm {\mathrm{C}\mathrm{H}}_{4}+2{\mathrm{N}\mathrm{O}}_{2}\xlongequal{一定条件}{\mathrm{N}}_{2}+{\mathrm{C}\mathrm{O}}_{2}+2{\mathrm{H}}_{2}\mathrm{O}} $ 消除氮氧化物的污染。反应中还原剂为 (填化学式);若反应中消耗 $ {\rm 1\mathrm{m}\mathrm{o}\mathrm{l}{\mathrm{C}\mathrm{H}}_{4}} $ ,则转移电子的物质的量为 $ \mathrm{m}\mathrm{o}\mathrm{l} $ 。
答案:(1) $ {\rm \mathrm{B}\mathrm{C}} $
(2) $ {\rm 2\mathrm{C}\mathrm{O}+2\mathrm{N}\mathrm{O}\xlongequal{催化剂}{\mathrm{N}}_{2}+2{\mathrm{C}\mathrm{O}}_{2}} $
(3) $ {\rm {\mathrm{C}\mathrm{H}}_{4}} $ ;8
解析:(1) 煤、石油和天然气燃烧及汽车尾气排放产生的硫氧化物、氮氧化物等溶于雨水会形成酸雨,故选 $ {\rm \mathrm{B}\mathrm{C}} $ 。
(2) 有害气体 $ {\rm \mathrm{N}\mathrm{O}} $ 、 $ {\rm \mathrm{C}\mathrm{O}} $ 在催化剂作用下转化为无害气体 $ {\rm {\mathrm{N}}_{2}} $ 和 $ {\rm {\mathrm{C}\mathrm{O}}_{2}} $ ,反应的化学方程式为 $ {\rm 2\mathrm{C}\mathrm{O}+2\mathrm{N}\mathrm{O}\xlongequal{催化剂}{\mathrm{N}}_{2}+2{\mathrm{C}\mathrm{O}}_{2}} $ 。
(3) 题给反应中, $ {\rm {\mathrm{C}\mathrm{H}}_{4}} $ 中碳元素化合价升高,由 $ -4 $ 价变为 $ +4 $ 价,被氧化,因此该反应中还原剂为 $ {\rm {\mathrm{C}\mathrm{H}}_{4}} $ ;若反应中消耗 $ {\rm 1\mathrm{m}\mathrm{o}\mathrm{l}{\mathrm{C}\mathrm{H}}_{4}} $ ,则转移电子的物质的量为 $ 8\mathrm{m}\mathrm{o}\mathrm{l} $ 。
4.氨和硝酸是重要的化工产品,工业合成氨及制备硝酸的流程如下:
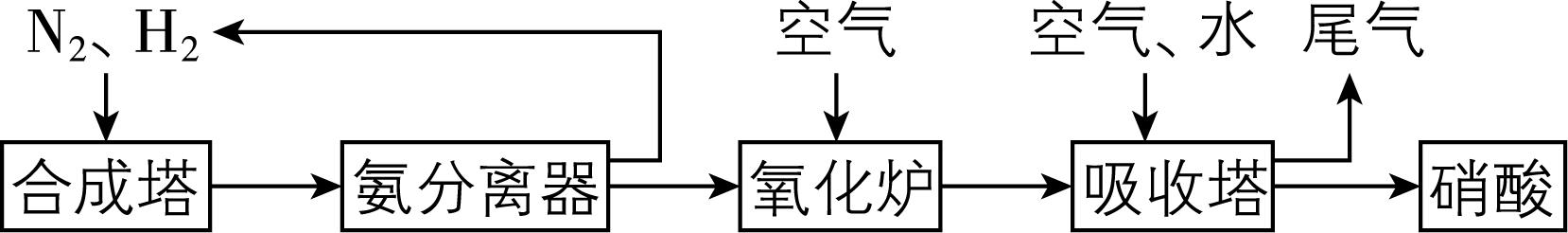
下列说法不正确的是( )
A. $ {\rm {\mathrm{N}}_{2}} $ 和 $ {\rm {\mathrm{H}}_{2}} $ 必须经过净化才能进入“合成塔”
B. “氨分离器”中主要应用了氨气易液化的性质
C. “氧化炉”中氨的催化氧化反应中氧化剂与还原剂的物质的量之比为 $ 4:5 $
D. 为提高氮的利用率,尾气可循环进入“吸收塔”
答案:C
解析:氮气、氢气在“合成塔”中反应生成氨气,“氨分离器”中氨气液化进入氧化炉,氮气、氢气进入“合成塔”循环利用, $ {\rm {\mathrm{N}\mathrm{H}}_{3}} $ 在“氧化炉”中发生催化氧化生成 $ {\rm \mathrm{N}\mathrm{O}} $ , $ {\rm \mathrm{N}\mathrm{O}} $ 和氧气、水反应生成硝酸。为防止催化剂中毒, $ {\rm {\mathrm{N}}_{2}} $ 和 $ {\rm {\mathrm{H}}_{2}} $ 必须经过净化才能进入“合成塔”, $ {\rm \mathrm{A}} $ 正确;“氨分离器”分离 $ {\rm {\mathrm{N}\mathrm{H}}_{3}} $ 和 $ {\rm {\mathrm{N}}_{2}} $ 、 $ {\rm {\mathrm{H}}_{2}} $ 主要应用了氨气易液化的性质, $ {\rm \mathrm{B}} $ 正确;“氧化炉”中氨的催化氧化反应方程式为 $ {\rm\hspace{-0.5em} \begin{array} {l} \rm 4{\mathrm{N}\mathrm{H}}_{3}+5{\mathrm{O}}_{2}\hspace{-0.5em} \begin{array}{c}{催化剂}\\ \overline{\overline{△}}\end{array} \hspace{-0.5em}4\mathrm{N}\mathrm{O}+6{\mathrm{H}}_{2}\mathrm{O}\end{array} \hspace{-0.5em} } $ , $ {\rm {\mathrm{N}\mathrm{H}}_{3}} $ 是还原剂、 $ {\rm {\mathrm{O}}_{2}} $ 是氧化剂,氧化剂与还原剂的物质的量之比为 $ 5:4 $ , $ {\rm \mathrm{C}} $ 错误;尾气中含有氮氧化物,为提高氮的利用率,尾气可循环进入“吸收塔”, $ {\rm \mathrm{D}} $ 正确。
5.酸雨的形成是一种复杂的大气化学和光化学过程,在清洁空气、污染空气中形成硫酸型酸雨的过程如图所示:
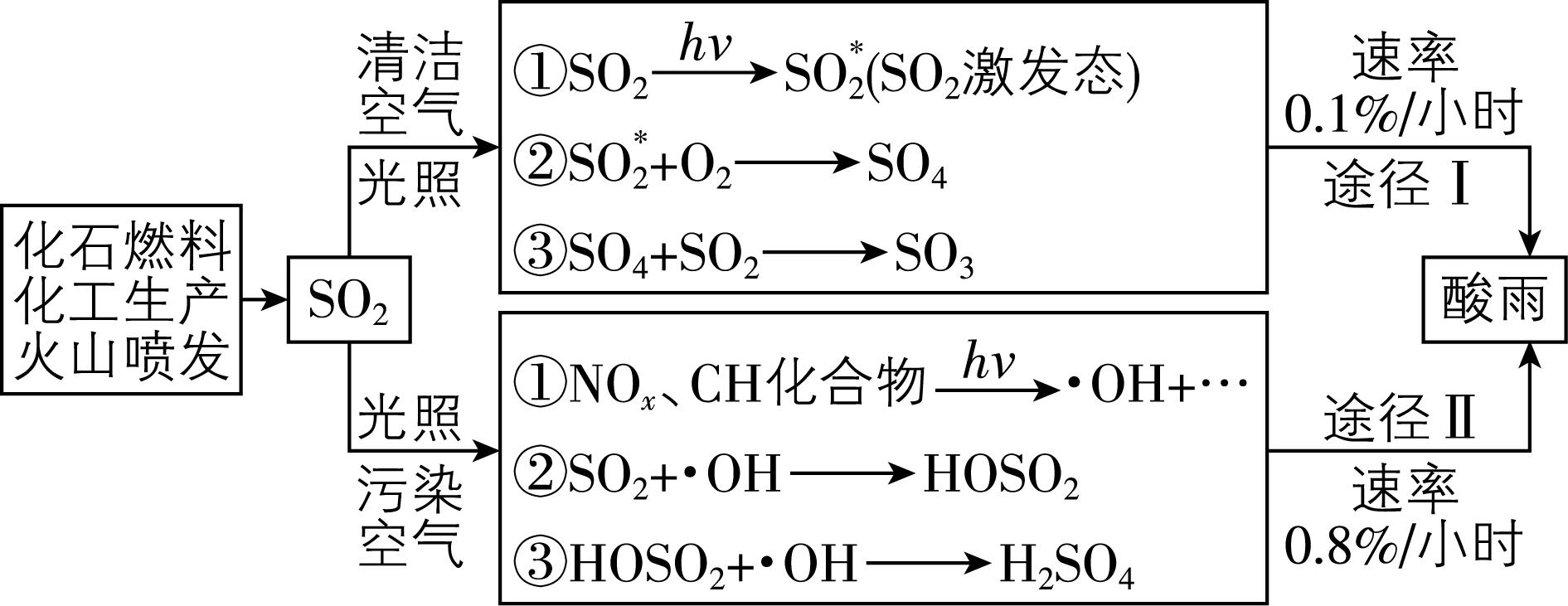
注: $ ℎ\nu $ 表示光照; $ {\rm \cdot \mathrm{O}\mathrm{H}} $ 是羟基自由基,有强氧化性。下列有关说法错误的是( )
A. 所涉及的变化均为氧化还原反应
B. 上述气相氧化形成酸雨的必要条件是光照
C. $ {\rm \cdot \mathrm{O}\mathrm{H}} $ 的生成加快了形成酸雨的速率
D. $ {\rm {\mathrm{S}\mathrm{O}}_{2}} $ 难以直接被 $ {\rm {\mathrm{O}}_{2}} $ 氧化
答案:A
解析: $ {\rm {\mathrm{S}\mathrm{O}}_{3}} $ 和水反应生成硫酸没有元素化合价变化,不属于氧化还原反应, $ {\rm \mathrm{A}} $ 错误;由题图可知,两种途径中第一步反应均需要在光照条件下发生,所以光照是形成酸雨的必要条件, $ {\rm \mathrm{B}} $ 正确;途径Ⅱ中 $ {\rm \cdot \mathrm{O}\mathrm{H}} $ 有强氧化性,能加快二氧化硫的氧化速率,所以 $ {\rm \cdot \mathrm{O}\mathrm{H}} $ 的生成加快了形成酸雨的速率, $ {\rm \mathrm{C}} $ 正确;两条途径中二氧化硫均不是直接转化为三氧化硫或硫酸的,这说明 $ {\rm {\mathrm{S}\mathrm{O}}_{2}} $ 难以直接被 $ {\rm {\mathrm{O}}_{2}} $ 氧化, $ {\rm \mathrm{D}} $ 正确。



