课时3 硝酸
一、刷基础
1.关于硝酸的说法正确的是( )
A. $ {\rm {\mathrm{N}\mathrm{O}}_{2}} $ 溶于水生成硝酸,所以 $ {\rm {\mathrm{N}\mathrm{O}}_{2}} $ 是酸性氧化物
B. 冷的稀硝酸可以保存在铝、铁制成的容器中
C. 浓硝酸久置会变黄是因为硝酸分解产生的 $ {\rm {\mathrm{N}\mathrm{O}}_{2}} $ 溶于其中
D. 硝酸与铜的反应中,硝酸只表现氧化性
答案:C
解析:酸性氧化物与碱反应只能生成一种盐和水,二氧化氮与 $ {\rm \mathrm{N}\mathrm{a}\mathrm{O}\mathrm{H}} $ 反应生成 $ {\rm {\mathrm{N}\mathrm{a}\mathrm{N}\mathrm{O}}_{2}} $ 、 $ {\rm {\mathrm{N}\mathrm{a}\mathrm{N}\mathrm{O}}_{3}} $ 和水,生成了两种盐,所以二氧化氮不是酸性氧化物, $ {\rm \mathrm{A}} $ 错误;稀硝酸具有强氧化性,能与铝、铁反应,所以冷的稀硝酸不能保存在铝、铁制成的容器中, $ {\rm \mathrm{B}} $ 错误;浓硝酸具有不稳定性,久置易分解生成二氧化氮、氧气和水,分解生成的二氧化氮溶于浓硝酸会使溶液变为黄色, $ {\rm \mathrm{C}} $ 正确;铜与硝酸反应时,氮元素的化合价部分降低被还原,部分不变形成 $ {\rm \mathrm{C}\mathrm{u}({\mathrm{N}\mathrm{O}}_{3})_{2}} $ ,硝酸表现酸性和氧化性, $ {\rm \mathrm{D}} $ 错误。
2.下列有关硝酸化学性质的叙述中,正确的是( )
A. 紫色石蕊试纸遇稀硝酸先变红后褪色
B. 稀硝酸能与 $ {\rm \mathrm{F}\mathrm{e}\mathrm{O}} $ 反应,只表现氧化性
C. 浓硝酸保存在棕色玻璃试剂瓶中
D. 硝酸可与 $ {\rm {\mathrm{N}\mathrm{a}}_{2}\mathrm{S}} $ 反应制得 $ {\rm {\mathrm{H}}_{2}\mathrm{S}} $ 气体
答案:C
解析:紫色石蕊试纸遇稀硝酸变红,不会褪色, $ {\rm \mathrm{A}} $ 错误;稀硝酸能与 $ {\rm \mathrm{F}\mathrm{e}\mathrm{O}} $ 反应生成硝酸铁、 $ {\rm \mathrm{N}\mathrm{O}} $ 和水,表现氧化性和酸性, $ {\rm \mathrm{B}} $ 错误;浓硝酸见光易分解,需要保存在棕色玻璃试剂瓶中, $ {\rm \mathrm{C}} $ 正确; $ {\rm {\mathrm{H}}_{2}\mathrm{S}} $ 具有还原性,硝酸属于氧化性酸,硝酸与 $ {\rm {\mathrm{N}\mathrm{a}}_{2}\mathrm{S}} $ 反应不能得到 $ {\rm {\mathrm{H}}_{2}\mathrm{S}} $ 气体, $ {\rm \mathrm{D}} $ 错误。
3.一定温度下,探究铜与稀 $ {\rm {\mathrm{H}\mathrm{N}\mathrm{O}}_{3}} $ 反应过程如图,下列说法错误的是( )
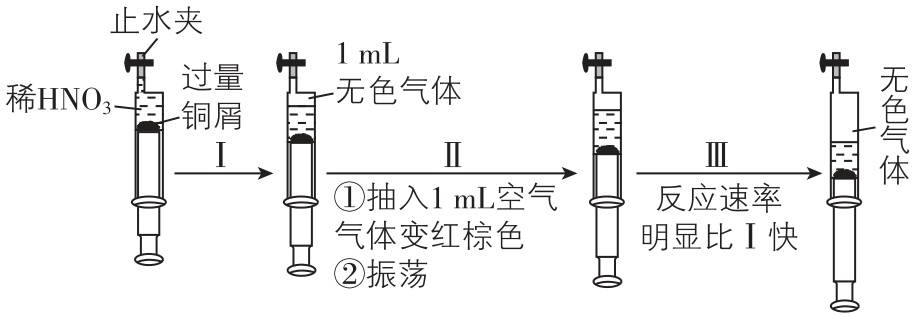
A. 产生无色气体的离子方程式是 $ {\rm 3\mathrm{C}\mathrm{u}+8{\mathrm{H}}^{+}+2{\mathrm{N}\mathrm{O}}_{3}^{-}\xlongequal{}3{\mathrm{C}\mathrm{u}}^{2+}+2\mathrm{N}\mathrm{O}↑+4{\mathrm{H}}_{2}\mathrm{O}} $
B. 步骤Ⅲ反应速率比Ⅰ快的原因是 $ {\rm 3{\mathrm{N}\mathrm{O}}_{2}+{\mathrm{H}}_{2}\mathrm{O}\xlongequal{}2{\mathrm{H}\mathrm{N}\mathrm{O}}_{3}+\mathrm{N}\mathrm{O}} $ ,使 $ {\rm c({\mathrm{H}\mathrm{N}\mathrm{O}}_{3})} $ 增大
C. 无色气体变红棕色的化学方程式是 $ {\rm 2\mathrm{N}\mathrm{O}+{\mathrm{O}}_{2}\xlongequal{}2{\mathrm{N}\mathrm{O}}_{2}} $
D. 当活塞不再移动时,再抽入空气,铜会继续溶解
答案:B
解析: $ {\rm \mathrm{C}\mathrm{u}} $ 和稀 $ {\rm {\mathrm{H}\mathrm{N}\mathrm{O}}_{3}} $ 反应的离子方程式为 $ {\rm 3\mathrm{C}\mathrm{u}+8{\mathrm{H}}^{+}+2{\mathrm{N}\mathrm{O}}_{3}^{-}\xlongequal{}3{\mathrm{C}\mathrm{u}}^{2+}+2\mathrm{N}\mathrm{O}↑+4{\mathrm{H}}_{2}\mathrm{O}} $ , $ {\rm \mathrm{A}} $ 正确; $ {\rm {\mathrm{N}\mathrm{O}}_{2}} $ 转化为 $ {\rm {\mathrm{H}\mathrm{N}\mathrm{O}}_{3}} $ 后,稀硝酸的浓度仍小于原稀硝酸浓度,对比Ⅰ和Ⅲ的不同知,步骤Ⅲ反应速率比Ⅰ快的原因是二氧化氮对反应具有催化作用, $ {\rm \mathrm{B}} $ 错误;一氧化氮与氧气反应生成二氧化氮,二氧化氮为红棕色,化学方程式为 $ {\rm 2\mathrm{N}\mathrm{O}+{\mathrm{O}}_{2}\xlongequal{}2{\mathrm{N}\mathrm{O}}_{2}} $ , $ {\rm \mathrm{C}} $ 正确;当活塞不再移动时,再抽入空气, $ {\rm \mathrm{N}\mathrm{O}} $ 与氧气、水反应生成硝酸,因此铜可以继续溶解, $ {\rm \mathrm{D}} $ 正确。
4.某中学化学兴趣小组用足量的铜与一定量的浓硝酸充分反应,得到 $ {\rm 0.3\mathrm{m}\mathrm{o}\mathrm{l}{\mathrm{N}\mathrm{O}}_{2}} $ 与 $ {\rm \mathrm{N}\mathrm{O}} $ 的混合气体,这些气体与一定体积的 $ {\rm {\mathrm{O}}_{2}} $ 混合后通入水中,恰好被完全吸收生成硝酸。该兴趣小组又向所得硝酸铜溶液中加 $ {\rm 100\mathrm{m}\mathrm{L}6\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}\mathrm{N}\mathrm{a}\mathrm{O}\mathrm{H}} $ 溶液, $ {\rm {\mathrm{C}\mathrm{u}}^{2+}} $ 恰好沉淀完全。下列说法正确的是( )
A. 参加反应的 $ {\rm {\mathrm{H}\mathrm{N}\mathrm{O}}_{3}} $ 的物质的量是 $ 0.75\mathrm{m}\mathrm{o}\mathrm{l} $
B. 消耗氧气的体积为 $ {\rm 6.72\mathrm{L}} $ (标准状况下)
C. 混合气体中含 $ {\rm 1.12\mathrm{L}\mathrm{N}\mathrm{O}} $ (标准状况下)
D. 此反应过程中转移了 $ 0.6\mathrm{m}\mathrm{o}\mathrm{l} $ 的电子
答案:D
解析:由思路导引可知,参加反应的硝酸的物质的量为 $ 0.9\mathrm{m}\mathrm{o}\mathrm{l} $ , $ {\rm \mathrm{A}} $ 错误;消耗氧气的物质的量为 $ 0.15\mathrm{m}\mathrm{o}\mathrm{l} $ ,则标准状况下氧气的体积为 $ {\rm 0.15\mathrm{m}\mathrm{o}\mathrm{l}×22.4\mathrm{L}\cdot {\mathrm{m}\mathrm{o}\mathrm{l}}^{-1}=3.36\mathrm{L}} $ , $ {\rm \mathrm{B}} $ 错误;混合气体中一氧化氮的物质的量为 $ 0.15\mathrm{m}\mathrm{o}\mathrm{l} $ ,则标准状况下一氧化氮的体积为 $ {\rm 0.15\mathrm{m}\mathrm{o}\mathrm{l}×22.4\mathrm{L}\cdot {\mathrm{m}\mathrm{o}\mathrm{l}}^{-1}=3.36\mathrm{L}} $ , $ {\rm \mathrm{C}} $ 错误;反应消耗铜的物质的量为 $ 0.3\mathrm{m}\mathrm{o}\mathrm{l} $ ,则反应转移电子的物质的量为 $ 0.3\mathrm{m}\mathrm{o}\mathrm{l}×2=0.6\mathrm{m}\mathrm{o}\mathrm{l} $ , $ {\rm \mathrm{D}} $ 正确。
5.某稀硫酸和稀硝酸的混合溶液 $ {\rm 200\mathrm{m}\mathrm{L}} $ ,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解 $ 19.2\mathrm{g} $ 铜(已知硝酸只被还原为 $ {\rm \mathrm{N}\mathrm{O}} $ 气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。下列分析或结果不正确的是( )
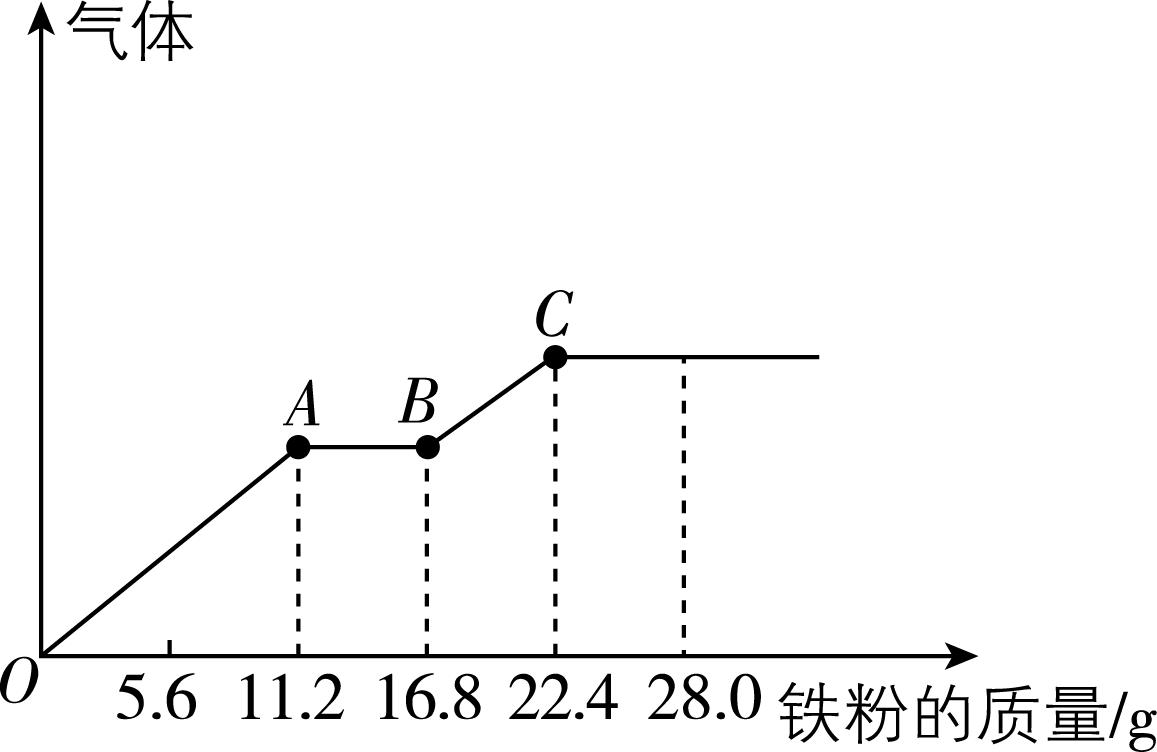
A. 原混合溶液中 $ {\rm {\mathrm{H}}_{2}{\mathrm{S}\mathrm{O}}_{4}} $ 物质的量为 $ 0.4\mathrm{m}\mathrm{o}\mathrm{l} $
B. $ {\rm AB} $ 段发生的离子反应为 $ {\rm \mathrm{F}\mathrm{e}+2{\mathrm{F}\mathrm{e}}^{3+}\xlongequal{}3{\mathrm{F}\mathrm{e}}^{2+}} $
C. 混合溶液中 $ {\rm {\mathrm{H}\mathrm{N}\mathrm{O}}_{3}} $ 物质的量浓度为 $ {\rm 2\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}} $
D. 第二份溶液中最终溶质为 $ {\rm {\mathrm{F}\mathrm{e}\mathrm{S}\mathrm{O}}_{4}} $
答案:A
解析:由题给图像可知,加入铁粉至过量过程中, $ {\rm OA} $ 段发生反应 $ {\rm \mathrm{F}\mathrm{e}+{\mathrm{N}\mathrm{O}}_{3}^{-}+4{\mathrm{H}}^{+}\xlongequal{}{\mathrm{F}\mathrm{e}}^{3+}+\mathrm{N}\mathrm{O}↑+2{\mathrm{H}}_{2}\mathrm{O}} $ , $ {\rm AB} $ 段发生反应 $ {\rm \mathrm{F}\mathrm{e}+2{\mathrm{F}\mathrm{e}}^{3+}\xlongequal{}3{\mathrm{F}\mathrm{e}}^{2+}} $ , $ {\rm BC} $ 段发生反应 $ {\rm \mathrm{F}\mathrm{e}+2{\mathrm{H}}^{+}\xlongequal{}{\mathrm{F}\mathrm{e}}^{2+}+{\mathrm{H}}_{2}↑} $ , $ {\rm \mathrm{B}} $ 正确;由分析知, $ {\rm B} $ 点溶液中溶质为 $ {\rm {\mathrm{F}\mathrm{e}\mathrm{S}\mathrm{O}}_{4}} $ 和 $ {\rm {\mathrm{H}}_{2}{\mathrm{S}\mathrm{O}}_{4}} $ , $ {\rm C} $ 点时, $ {\rm 100\mathrm{m}\mathrm{L}} $ 该溶液反应消耗的 $ 22.4\mathrm{g} $ (即 $ 0.4\mathrm{m}\mathrm{o}\mathrm{l} $ )铁都转化为硫酸亚铁,根据硫酸根离子守恒,可得每份溶液中硫酸的物质的量为 $ 0.4\mathrm{m}\mathrm{o}\mathrm{l} $ ,所以硫酸的浓度是 $ {\rm 4\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}} $ , $ {\rm 200\mathrm{m}\mathrm{L}} $ 的原混合溶液中 $ {\rm {\mathrm{H}}_{2}{\mathrm{S}\mathrm{O}}_{4}} $ 的物质的量为 $ {\rm 4\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}×0.2\mathrm{L}=0.8\mathrm{m}\mathrm{o}\mathrm{l}} $ , $ {\rm \mathrm{A}} $ 错误, $ {\rm \mathrm{D}} $ 正确; $ {\rm OA} $ 段发生反应 $ {\rm \mathrm{F}\mathrm{e}+{\mathrm{N}\mathrm{O}}_{3}^{-}+4{\mathrm{H}}^{+}\xlongequal{}{\mathrm{F}\mathrm{e}}^{3+}+\mathrm{N}\mathrm{O}↑+2{\mathrm{H}}_{2}\mathrm{O}} $ , $ {\rm A} $ 点时有 $ {\rm {\mathrm{H}}^{+}} $ 剩余,则 $ {\rm A} $ 点时硝酸全部起氧化剂作用,所以混合溶液中 $ {\rm n({\mathrm{N}\mathrm{O}}_{3}^{-})={n}_{A}(\mathrm{F}\mathrm{e})=\dfrac{11.2\mathrm{g}}{56\mathrm{g}\cdot {\mathrm{m}\mathrm{o}\mathrm{l}}^{-1}}=0.2\mathrm{m}\mathrm{o}\mathrm{l}} $ ,混合溶液中 $ {\rm {\mathrm{H}\mathrm{N}\mathrm{O}}_{3}} $ 物质的量浓度为 $ {\rm \dfrac{0.2\mathrm{m}\mathrm{o}\mathrm{l}}{0.1\mathrm{L}}=2\mathrm{m}\mathrm{o}\mathrm{l}\cdot {\mathrm{L}}^{-1}} $ , $ {\rm \mathrm{C}} $ 正确。

