1.下列关于液氨、氨气、氨水和铵盐的叙述正确的是( )
A. 液氨可用作制冷剂
B. 液氨、氨气、氨水属于同一种物质
C. 氨水中只含有 $ {\rm {\mathrm{N}\mathrm{H}}_{3}} $ 和 $ {\rm {\mathrm{H}}_{2}\mathrm{O}} $ 两种分子
D. 氨气和铵盐在一定条件下均能导电,均属于电解质
答案:A
解析:氨气易液化,液氨汽化时吸收大量热,使周围环境的温度急剧降低,常用作制冷剂, $ {\rm \mathrm{A}} $ 正确;液氨和氨气属于同一种物质,氨水是氨气的水溶液, $ {\rm \mathrm{B}} $ 错误;氨水中含有 $ {\rm {\mathrm{N}\mathrm{H}}_{3}} $ 、 $ {\rm {\mathrm{H}}_{2}\mathrm{O}} $ 、 $ {\rm {\mathrm{N}\mathrm{H}}_{3}\cdot {\mathrm{H}}_{2}\mathrm{O}} $ 三种分子, $ {\rm \mathrm{C}} $ 错误;氨气自身不能电离,氨气不属于电解质, $ {\rm \mathrm{D}} $ 错误。
2.如图所示,利用培养皿探究 $ {\rm {\mathrm{N}\mathrm{H}}_{3}} $ 的性质。实验时向 $ {\rm \mathrm{N}\mathrm{a}\mathrm{O}\mathrm{H}} $ 固体上滴几滴浓氨水,立即用另一培养皿扣在上面。下表中对实验现象所做的解释正确的是( )
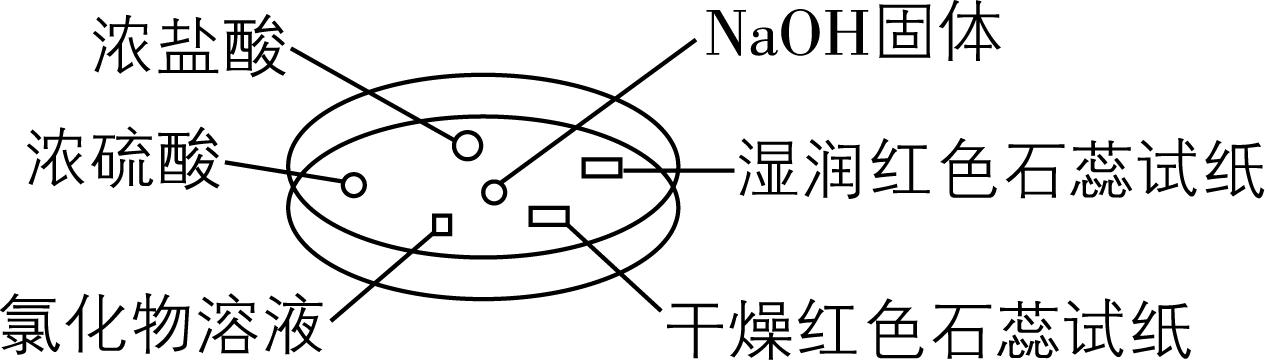
选项 | 实验现象 | 解释 |
A | 浓盐酸附近产生白烟 | $ {\rm {\mathrm{N}\mathrm{H}}_{3}} $ 与 $ {\rm \mathrm{H}\mathrm{C}\mathrm{l}} $ 反应生成 $ {\rm {\mathrm{N}\mathrm{H}}_{4}\mathrm{C}\mathrm{l}} $ 固体 |
B | 浓硫酸附近无现象 | $ {\rm {\mathrm{N}\mathrm{H}}_{3}} $ 与浓硫酸不反应 |
C | 氯化物溶液变浑浊 | 该溶液一定是 $ {\rm {\mathrm{M}\mathrm{g}\mathrm{C}\mathrm{l}}_{2}} $ 溶液 |
D | 干燥红色石蕊试纸不变色,湿润红色石蕊试纸变蓝 | $ {\rm {\mathrm{N}\mathrm{H}}_{3}} $ 是可溶性碱 |
解析: $ {\rm \mathrm{N}\mathrm{a}\mathrm{O}\mathrm{H}} $ 固体溶于水放热,氨水易挥发,实验时向 $ {\rm \mathrm{N}\mathrm{a}\mathrm{O}\mathrm{H}} $ 固体上滴几滴浓氨水,会产生氨气,氨气会与浓盐酸挥发出的 $ {\rm \mathrm{H}\mathrm{C}\mathrm{l}} $ 反应生成氯化铵固体,反应现象是产生白烟, $ {\rm \mathrm{A}} $ 正确;氨气为碱性气体,与浓硫酸发生反应生成硫酸铵或硫酸氢铵, $ {\rm \mathrm{B}} $ 错误;氯化物溶液变浑浊,说明氨气与 $ {\rm {\mathrm{H}}_{2}\mathrm{O}} $ 反应产生的 $ {\rm {\mathrm{N}\mathrm{H}}_{3}\cdot {\mathrm{H}}_{2}\mathrm{O}} $ 与氯化物在溶液中发生复分解反应生成难溶性氢氧化物,但难溶物不一定为 $ {\rm \mathrm{M}\mathrm{g}(\mathrm{O}\mathrm{H})_{2}} $ ,也可能为 $ {\rm \mathrm{A}\mathrm{l}(\mathrm{O}\mathrm{H})_{3}} $ 等, $ {\rm \mathrm{C}} $ 错误;氨气使湿润的红色石蕊试纸变蓝的原因是其与水反应生成 $ {\rm {\mathrm{N}\mathrm{H}}_{3}\cdot {\mathrm{H}}_{2}\mathrm{O}} $ , $ {\rm {\mathrm{N}\mathrm{H}}_{3}\cdot {\mathrm{H}}_{2}\mathrm{O}} $ 电离生成的 $ {\rm {\mathrm{O}\mathrm{H}}^{-}} $ 使溶液呈碱性, $ {\rm {\mathrm{O}\mathrm{H}}^{-}} $ 不是 $ {\rm {\mathrm{N}\mathrm{H}}_{3}} $ 电离产生的, $ {\rm {\mathrm{N}\mathrm{H}}_{3}} $ 不属于碱, $ {\rm \mathrm{D}} $ 错误。
3.如图所示,干燥的烧瓶中充满氨,打开弹簧夹,将滴管中的水挤入烧瓶内,烧杯中的水则呈喷泉状喷出,最终液体占烧瓶容积的 $ \dfrac{5}{6} $ 。对实验现象的分析正确的是( )
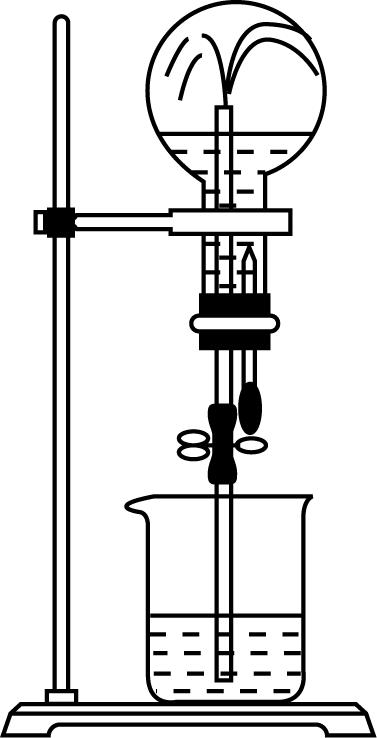
A. 烧杯中的水喷入烧瓶,说明 $ {\rm {\mathrm{N}\mathrm{H}}_{3}} $ 与 $ {\rm {\mathrm{H}}_{2}\mathrm{O}} $ 发生了反应
B. 烧瓶内剩余气体,是因为 $ {\rm {\mathrm{N}\mathrm{H}}_{3}} $ 的溶解已达饱和
C. 喷泉停止后,加热烧瓶,则烧杯中的水会继续喷入烧瓶
D. 取出烧瓶中的溶液,加入酚酞溶液,溶液显红色,原因是 $ {\rm {\mathrm{N}\mathrm{H}}_{3}+{\mathrm{H}}_{2}\mathrm{O}⇌{\mathrm{N}\mathrm{H}}_{3}\cdot {\mathrm{H}}_{2}\mathrm{O}⇌{\mathrm{N}\mathrm{H}}_{4}^{+}+{\mathrm{O}\mathrm{H}}^{-}} $
答案:D
解析:烧瓶中形成喷泉,不一定是因为氨气与水发生了反应,还有可能是因为氨气极易溶于水, $ {\rm \mathrm{A}} $ 错误;烧瓶中剩余的气体可能是空气等不溶于水的气体,常温常压下,1体积水大约可溶解700体积氨,烧瓶内 $ {\rm {\mathrm{N}\mathrm{H}}_{3}} $ 的溶解未达饱和, $ {\rm \mathrm{B}} $ 错误;喷泉停止后,加热烧瓶,一水合氨分解产生氨气,瓶内压强增大,则烧杯中的水不会继续喷入烧瓶, $ {\rm \mathrm{C}} $ 错误;烧瓶中溶液在加入酚酞溶液后变红,说明溶液呈碱性,原因是 $ {\rm {\mathrm{N}\mathrm{H}}_{3}} $ 与 $ {\rm {\mathrm{H}}_{2}\mathrm{O}} $ 反应生成的弱碱 $ {\rm {\mathrm{N}\mathrm{H}}_{3}\cdot {\mathrm{H}}_{2}\mathrm{O}} $ 电离出 $ {\rm {\mathrm{O}\mathrm{H}}^{-}} $ ,即 $ {\rm {\mathrm{N}\mathrm{H}}_{3}+{\mathrm{H}}_{2}\mathrm{O}⇌{\mathrm{N}\mathrm{H}}_{3}\cdot {\mathrm{H}}_{2}\mathrm{O}⇌{\mathrm{N}\mathrm{H}}_{4}^{+}+{\mathrm{O}\mathrm{H}}^{-}} $ , $ {\rm \mathrm{D}} $ 正确。
4.下列说法正确的是( )
A. 铵盐都能与碱反应,不能与酸反应
B. 铵盐受热分解一定都会产生 $ {\rm {\mathrm{N}\mathrm{H}}_{3}} $
C. 向 $ {\rm {\mathrm{N}\mathrm{H}}_{4}\mathrm{C}\mathrm{l}} $ 溶液中加入 $ {\rm \mathrm{N}\mathrm{a}\mathrm{O}\mathrm{H}} $ 浓溶液并加热,反应的离子方程式为 $ {\rm {\mathrm{N}\mathrm{H}}_{4}^{+}+{\mathrm{O}\mathrm{H}}^{-}\xlongequal{△}{\mathrm{N}\mathrm{H}}_{3}↑+{\mathrm{H}}_{2}\mathrm{O}} $
D. 可以用 $ {\rm \mathrm{N}\mathrm{a}\mathrm{O}\mathrm{H}} $ 溶液鉴别 $ {\rm {\mathrm{N}\mathrm{a}}_{2}{\mathrm{S}\mathrm{O}}_{4}} $ 、 $ {\rm {\mathrm{N}\mathrm{H}}_{4}{\mathrm{N}\mathrm{O}}_{3}} $ 、 $ {\rm \mathrm{K}\mathrm{C}\mathrm{l}} $ 、 $ {\rm ({\mathrm{N}\mathrm{H}}_{4})_{2}{\mathrm{S}\mathrm{O}}_{4}} $ 四种溶液
答案:C
解析:碳酸氢铵可以和酸反应, $ {\rm \mathrm{A}} $ 错误;铵盐受热分解的产物受温度的影响而有所不同,如 $ 400℃ $ 以上时,硝酸铵受热分解不生成 $ {\rm {\mathrm{N}\mathrm{H}}_{3}} $ , $ {\rm \mathrm{B}} $ 错误;铵根离子与碱反应时加热会放出氨气, $ {\rm \mathrm{C}} $ 正确;氢氧化钠不和硫酸钠、氯化钾反应,都无现象,无法鉴别,与硝酸铵和硫酸铵反应都会生成有刺激性气味的气体,也不可鉴别, $ {\rm \mathrm{D}} $ 错误。
5.氨对人类生产、生活有重要影响。回答下列问题:
(1) 合成氨是工业上人工固氮的重要方法,写出该反应的化学方程式: 。
(2) 用氯化铵和氢氧化钙混合加热进行氨气的制备。
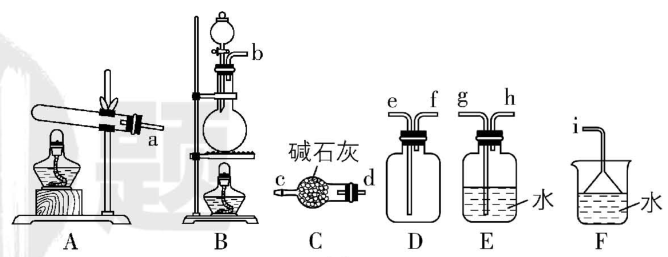
甲
① 氨气的发生装置可以选择图甲中的 (填序号),反应的化学方程式为 。
② 欲收集一瓶干燥的氨气,选择图甲中的装置,其连接顺序为发生装置 $ \to $ (按气流方向,用小写字母表示)。
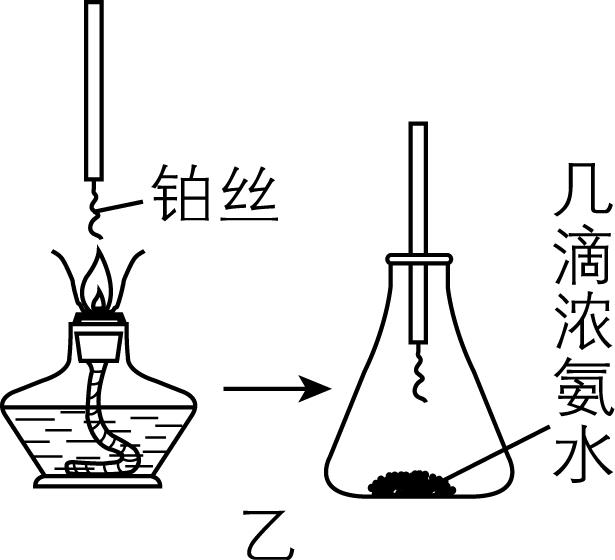
(3) 氨的催化氧化:如图乙是探究氨的催化氧化的简易装置,实验时观察到锥形瓶中铂丝保持红热,有红棕色气体或白烟产生。红棕色气体成分是 (填化学式,下同),白烟的成分是 。
答案:(1) $ {\rm {\mathrm{N}}_{2}+3{\mathrm{H}}_{2}\stackrel{高温{、}高压}{\underset{催化剂}{⇌}}2{\mathrm{N}\mathrm{H}}_{3}} $
(2) ① A; $ {\rm 2{\mathrm{N}\mathrm{H}}_{4}\mathrm{C}\mathrm{l}+\mathrm{C}\mathrm{a}(\mathrm{O}\mathrm{H})_{2}\xlongequal{△}2{\mathrm{N}\mathrm{H}}_{3}↑+{\mathrm{C}\mathrm{a}\mathrm{C}\mathrm{l}}_{2}+2{\mathrm{H}}_{2}\mathrm{O}} $
② $ \mathrm{d}\mathrm{c}\mathrm{f}\mathrm{e}\mathrm{i} $
(3) $ {\rm {\mathrm{N}\mathrm{O}}_{2}} $ ; $ {\rm {\mathrm{N}\mathrm{H}}_{4}{\mathrm{N}\mathrm{O}}_{3}} $
解析:(1) 氮气和氢气在催化剂、高温、高压下反应生成氨气,化学方程式为 $ {\rm {\mathrm{N}}_{2}+3{\mathrm{H}}_{2}\stackrel{高温{、}高压}{\underset{催化剂}{⇌}}2{\mathrm{N}\mathrm{H}}_{3}} $ 。
(2) ① 氯化铵和氢氧化钙固体在加热条件下反应生成氨气、氯化钙和水: $ {\rm \mathrm{C}\mathrm{a}(\mathrm{O}\mathrm{H})_{2}+2{\mathrm{N}\mathrm{H}}_{4}\mathrm{C}\mathrm{l}\xlongequal{△}{\mathrm{C}\mathrm{a}\mathrm{C}\mathrm{l}}_{2}+2{\mathrm{N}\mathrm{H}}_{3}↑+2{\mathrm{H}}_{2}\mathrm{O}} $ ,该反应为固体加热反应,则氨气的发生装置可以选择题图甲中的 $ {\rm \mathrm{A}} $ 。
② 欲收集一瓶干燥的氨气, $ {\rm \mathrm{A}} $ 中生成氨气,经过 $ {\rm \mathrm{C}} $ 中碱石灰干燥后,使用 $ {\rm \mathrm{D}} $ (向下排空气法)收集,氨气极易溶于水,处理尾气时要使用 $ {\rm \mathrm{F}} $ 防倒吸,故其连接顺序为发生装置 $ \to \mathrm{d}\mathrm{c}\mathrm{f}\mathrm{e}\mathrm{i} $ 。
(3) 氨气发生催化氧化生成一氧化氮和水,方程式为 $ {\rm\hspace{-0.5em} \begin{array} {l} \rm 4{\mathrm{N}\mathrm{H}}_{3}+5{\mathrm{O}}_{2}\hspace{-0.5em} \begin{array}{c}{催化剂}\\ \overline{\overline{△}}\end{array} \hspace{-0.5em}4\mathrm{N}\mathrm{O}+6{\mathrm{H}}_{2}\mathrm{O}\end{array} \hspace{-0.5em} } $ ;生成的 $ {\rm \mathrm{N}\mathrm{O}} $ 被氧气氧化为 $ {\rm {\mathrm{N}\mathrm{O}}_{2}} $ ,二氧化氮为红棕色气体; $ {\rm {\mathrm{N}\mathrm{O}}_{2}} $ 与水反应生成硝酸,硝酸与氨气反应生成硝酸铵,出现了白烟,因此白烟的成分是 $ {\rm {\mathrm{N}\mathrm{H}}_{4}{\mathrm{N}\mathrm{O}}_{3}} $ 。



