第一节综合训练
一、刷能力
1.硫元素的“价—类”二维图如图所示。下列有关叙述正确的是( )
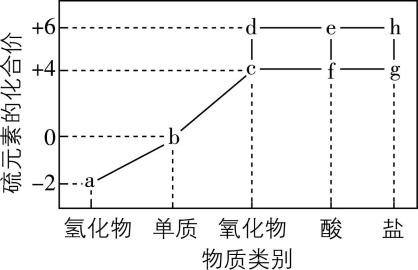
A. 硫元素的性质活泼,自然界中不存在 $ \mathrm{b} $
B. 物质 $ \mathrm{a} $ 与 $ \mathrm{c} $ 、 $ \mathrm{f} $ 、 $ \mathrm{e} $ 都有可能发生化学反应生成 $ \mathrm{b} $
C. 将 $ \mathrm{c} $ 通入品红溶液中,溶液红色加深后褪色
D. 将 $ \mathrm{f} $ 的水溶液在空气中放置一段时间,其 $ {\rm \mathrm{p}\mathrm{H}} $ 将增大
答案:B
解析:自然界中存在游离态的硫,主要存在于火山口附近或地壳岩层中, $ {\rm \mathrm{A}} $ 错误; $ \mathrm{a} $ (硫化氢)和 $ \mathrm{c} $ (二氧化硫)反应生成硫和水, $ \mathrm{a} $ (硫化氢)和 $ \mathrm{f} $ (亚硫酸)反应生成硫和水, $ \mathrm{a} $ (硫化氢)和 $ \mathrm{e} $ (浓硫酸)反应生成硫、二氧化硫和水, $ \mathrm{b} $ 为硫,因此 $ \mathrm{a} $ 与 $ \mathrm{c} $ 、 $ \mathrm{f} $ 、 $ \mathrm{e} $ 都有可能发生化学反应生成 $ \mathrm{b} $ , $ {\rm \mathrm{B}} $ 正确; $ {\rm {\mathrm{S}\mathrm{O}}_{2}} $ 具有漂白性,将 $ {\rm {\mathrm{S}\mathrm{O}}_{2}} $ 通入品红溶液中,品红溶液褪色, $ {\rm \mathrm{C}} $ 错误;将 $ {\rm {\mathrm{H}}_{2}{\mathrm{S}\mathrm{O}}_{3}} $ 的水溶液在空气中放置一段时间, $ {\rm {\mathrm{H}}_{2}{\mathrm{S}\mathrm{O}}_{3}} $ 具有较强还原性,易被氧气氧化为 $ {\rm {\mathrm{H}}_{2}{\mathrm{S}\mathrm{O}}_{4}} $ ,硫酸为强酸,酸性增强, $ {\rm \mathrm{p}\mathrm{H}} $ 将减小, $ {\rm \mathrm{D}} $ 错误。
2.将一支充满 $ {\rm {\mathrm{S}\mathrm{O}}_{2}} $ 的试管倒扣入下列溶液中,现象正确且能得出相应结论的是( )
选项 | 溶液 | 现象 | 结论 |
A | 蒸馏水 | 试管内液面上升 | $ {\rm {\mathrm{S}\mathrm{O}}_{2}} $ 与水反应生成酸 |
B | $ {\rm {\mathrm{H}}_{2}\mathrm{S}} $ 溶液 | 产生黄色沉淀 | $ {\rm {\mathrm{S}\mathrm{O}}_{2}} $ 有氧化性 |
C | 酚酞和 $ {\rm \mathrm{N}\mathrm{a}\mathrm{O}\mathrm{H}} $ 混合溶液 | 溶液红色变浅 | $ {\rm {\mathrm{S}\mathrm{O}}_{2}} $ 有漂白性 |
D | 氯化钡溶液 | 产生白色沉淀 | 亚硫酸能电离出 $ {\rm {\mathrm{S}\mathrm{O}}_{3}^{2-}} $ |
解析:二氧化硫易溶于水,将充满 $ {\rm {\mathrm{S}\mathrm{O}}_{2}} $ 的试管倒扣入蒸馏水中,试管内液面会上升,仅根据液面上升这一现象,不能得出 $ {\rm {\mathrm{S}\mathrm{O}}_{2}} $ 与水反应生成酸的结论, $ {\rm \mathrm{A}} $ 错误; $ {\rm {\mathrm{S}\mathrm{O}}_{2}} $ 与 $ {\rm {\mathrm{H}}_{2}\mathrm{S}} $ 溶液反应的化学方程式为 $ {\rm 2{\mathrm{H}}_{2}\mathrm{S}+{\mathrm{S}\mathrm{O}}_{2}\xlongequal{}3\mathrm{S}↓+2{\mathrm{H}}_{2}\mathrm{O}} $ ,会产生黄色沉淀硫,在该反应中, $ {\rm {\mathrm{S}\mathrm{O}}_{2}} $ 中硫元素的化合价从 $ +4 $ 降低到0,体现了 $ {\rm {\mathrm{S}\mathrm{O}}_{2}} $ 的氧化性, $ {\rm \mathrm{B}} $ 正确; $ {\rm {\mathrm{S}\mathrm{O}}_{2}} $ 能与 $ {\rm \mathrm{N}\mathrm{a}\mathrm{O}\mathrm{H}} $ 溶液反应,化学方程式为 $ {\rm {\mathrm{S}\mathrm{O}}_{2}+2\mathrm{N}\mathrm{a}\mathrm{O}\mathrm{H}\xlongequal{}{\mathrm{N}\mathrm{a}}_{2}{\mathrm{S}\mathrm{O}}_{3}+{\mathrm{H}}_{2}\mathrm{O}} $ ,导致溶液碱性减弱,酚酞溶液红色变浅,该现象不能说明 $ {\rm {\mathrm{S}\mathrm{O}}_{2}} $ 有漂白性, $ {\rm \mathrm{C}} $ 错误;由于亚硫酸的酸性弱于盐酸, $ {\rm {\mathrm{S}\mathrm{O}}_{2}} $ 与氯化钡溶液不反应,不会产生白色沉淀, $ {\rm \mathrm{D}} $ 错误。
3.硫元素的几种化合物及其单质存在下列转化关系(反应条件省略)。
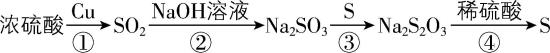
下列判断不正确的是( )
A. 反应①中氧化剂与还原剂的物质的量之比为 $ 1:1 $
B. 反应②表明 $ {\rm {\mathrm{S}\mathrm{O}}_{2}} $ 具有酸性氧化物的性质
C. 反应③的原子利用率是 $ 100\% $
D. 反应④中硫酸作氧化剂
答案:D
解析:反应①为浓硫酸氧化铜单质的反应,硫酸作氧化剂,被还原成 $ {\rm {\mathrm{S}\mathrm{O}}_{2}} $ , $ {\rm \mathrm{S}} $ 元素由 $ +6 $ 价降至 $ +4 $ 价, $ {\rm \mathrm{C}\mathrm{u}} $ 作还原剂,被氧化成 $ {\rm {\mathrm{C}\mathrm{u}}^{2+}} $ , $ {\rm \mathrm{C}\mathrm{u}} $ 元素由0价升高至 $ +2 $ 价,所以反应①中氧化剂与还原剂的物质的量之比为 $ 1:1 $ , $ {\rm \mathrm{A}} $ 正确;二氧化硫与 $ {\rm \mathrm{N}\mathrm{a}\mathrm{O}\mathrm{H}} $ 反应生成一种盐和水,表明二氧化硫为酸性氧化物, $ {\rm \mathrm{B}} $ 正确;反应③为 $ {\rm {\mathrm{N}\mathrm{a}}_{2}{\mathrm{S}\mathrm{O}}_{3}+\mathrm{S}\xlongequal{}{\mathrm{N}\mathrm{a}}_{2}{\mathrm{S}}_{2}{\mathrm{O}}_{3}} $ ,生成物只有一种,原子利用率是 $ 100\% $ , $ {\rm \mathrm{C}} $ 正确;反应④的化学方程式为 $ {\rm {\mathrm{N}\mathrm{a}}_{2}{\mathrm{S}}_{2}{\mathrm{O}}_{3}+{\mathrm{H}}_{2}{\mathrm{S}\mathrm{O}}_{4}\xlongequal{}{\mathrm{N}\mathrm{a}}_{2}{\mathrm{S}\mathrm{O}}_{4}+\mathrm{S}↓+{\mathrm{S}\mathrm{O}}_{2}↑+{\mathrm{H}}_{2}\mathrm{O}} $ , $ {\rm {\mathrm{H}}_{2}{\mathrm{S}\mathrm{O}}_{4}} $ 中各元素无化合价的变化,故硫酸既不是氧化剂也不是还原剂, $ {\rm \mathrm{D}} $ 错误。
4.下列离子方程式书写正确的是( )
A. 往 $ {\rm {\mathrm{N}\mathrm{a}\mathrm{H}\mathrm{S}\mathrm{O}}_{4}} $ 溶液中加 $ {\rm \mathrm{B}\mathrm{a}(\mathrm{O}\mathrm{H})_{2}} $ 溶液至中性: $ {\rm {\mathrm{B}\mathrm{a}}^{2+}+2{\mathrm{O}\mathrm{H}}^{-}+2{\mathrm{H}}^{+}+{\mathrm{S}\mathrm{O}}_{4}^{2-}\xlongequal{}{\mathrm{B}\mathrm{a}\mathrm{S}\mathrm{O}}_{4}↓+2{\mathrm{H}}_{2}\mathrm{O}} $
B. 已知酸性: $ {\rm {\mathrm{H}}_{2}{\mathrm{S}\mathrm{O}}_{3} > \mathrm{H}\mathrm{C}\mathrm{l}\mathrm{O}} $ ,向次氯酸钙溶液中通入 $ {\rm {\mathrm{S}\mathrm{O}}_{2}:{\mathrm{C}\mathrm{a}}^{2+}+2{\mathrm{C}\mathrm{l}\mathrm{O}}^{-}+{\mathrm{S}\mathrm{O}}_{2}+{\mathrm{H}}_{2}\mathrm{O}\xlongequal{}{\mathrm{C}\mathrm{a}\mathrm{S}\mathrm{O}}_{3}↓+2\mathrm{H}\mathrm{C}\mathrm{l}\mathrm{O}} $
C. 将过量的 $ {\rm {\mathrm{S}\mathrm{O}}_{2}} $ 通入饱和 $ {\rm {\mathrm{N}\mathrm{a}\mathrm{H}\mathrm{C}\mathrm{O}}_{3}} $ 溶液中: $ {\rm 2{\mathrm{H}}^{+}+{\mathrm{C}\mathrm{O}}_{3}^{2-}\xlongequal{}{\mathrm{H}}_{2}\mathrm{O}+{\mathrm{C}\mathrm{O}}_{2}↑} $
D. 向 $ {\rm {\mathrm{N}\mathrm{a}}_{2}\mathrm{S}} $ 溶液中通入过量 $ {\rm {\mathrm{S}\mathrm{O}}_{2}:2{\mathrm{S}}^{2-}+3{\mathrm{S}\mathrm{O}}_{2}\xlongequal{}3\mathrm{S}↓+2{\mathrm{S}\mathrm{O}}_{3}^{2-}} $
答案:A
解析: $ {\rm {\mathrm{N}\mathrm{a}\mathrm{H}\mathrm{S}\mathrm{O}}_{4}} $ 与 $ {\rm \mathrm{B}\mathrm{a}(\mathrm{O}\mathrm{H})_{2}} $ 反应至中性时,前者物质的量是后者的2倍,离子方程式为 $ {\rm {\mathrm{B}\mathrm{a}}^{2+}+2{\mathrm{O}\mathrm{H}}^{-}+2{\mathrm{H}}^{+}+{\mathrm{S}\mathrm{O}}_{4}^{2-}\xlongequal{}{\mathrm{B}\mathrm{a}\mathrm{S}\mathrm{O}}_{4}↓+2{\mathrm{H}}_{2}\mathrm{O}} $ , $ {\rm \mathrm{A}} $ 正确;次氯酸具有强氧化性,最终生成 $ {\rm {\mathrm{C}\mathrm{a}\mathrm{S}\mathrm{O}}_{4}} $ 和 $ {\rm {\mathrm{C}\mathrm{l}}^{-}} $ , $ {\rm \mathrm{B}} $ 错误;碳酸氢根离子为弱酸的酸式酸根离子,二氧化硫为氧化物,都不能拆, $ {\rm \mathrm{C}} $ 错误;过量的二氧化硫还能够和亚硫酸根离子继续反应生成亚硫酸氢根离子,离子方程式应为 $ {\rm 2{\mathrm{S}}^{2-}+5{\mathrm{S}\mathrm{O}}_{2}+2{\mathrm{H}}_{2}\mathrm{O}\xlongequal{}3\mathrm{S}↓+4{\mathrm{H}\mathrm{S}\mathrm{O}}_{3}^{-}} $ , $ {\rm \mathrm{D}} $ 错误。
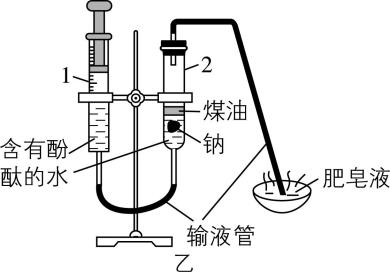
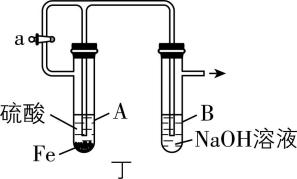
5.实验改进与优化应遵循科学性、易操作性、安全性的原则,提升化学实验效率。下列有关实验改进分析不正确的是( )
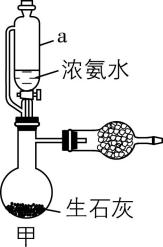
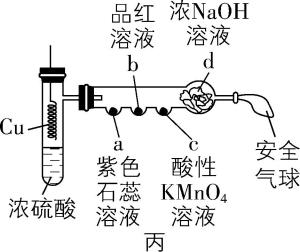
A. 甲中使用恒压滴液漏斗可防止浓氨水污染环境,并使漏斗内液体顺利流下
B. 乙中用点燃的木条靠近肥皂泡,听到爆鸣声,可检验产物中有氢气
C. 利用丙装置可制取 $ {\rm {\mathrm{S}\mathrm{O}}_{2}} $ ,并进行 $ {\rm {\mathrm{S}\mathrm{O}}_{2}} $ 性质的探究实验
D. 利用丁装置可较长时间看到白色絮状沉淀
答案:C
解析:恒压滴液漏斗为密闭装置且能平衡压强,使用恒压滴液漏斗可防止浓氨水污染环境,并使漏斗内液体顺利流下, $ {\rm \mathrm{A}} $ 正确。在煤油与水的交界面处,钠与水反应生成氢气,氢气具有可燃性,和氧气混合点燃容易爆炸;乙中用点燃的木条靠近肥皂泡,听到爆鸣声,可检验产物中有氢气, $ {\rm \mathrm{B}} $ 正确。铜和浓硫酸需要加热才能反应生成二氧化硫, $ {\rm \mathrm{C}} $ 错误。 $ {\rm \mathrm{A}} $ 中生成氢气,能排净装置中空气且生成硫酸亚铁,反应一段时间后关闭 $ \mathrm{a} $ , $ {\rm \mathrm{A}} $ 中压强变大,硫酸亚铁溶液被压入 $ {\rm \mathrm{B}} $ 中与 $ {\rm \mathrm{N}\mathrm{a}\mathrm{O}\mathrm{H}} $ 溶液反应生成氢氧化亚铁沉淀,由于装置中空气被排净,所以利用此装置可较长时间看到白色絮状沉淀, $ {\rm \mathrm{D}} $ 正确。
6.工业上煅烧含硫矿物产生的 $ {\rm {\mathrm{S}\mathrm{O}}_{2}} $ 可以按如下流程脱除或利用。
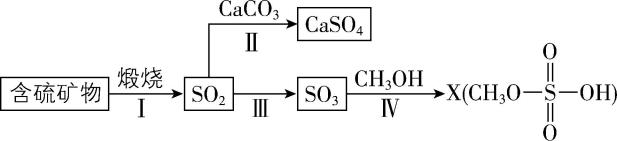
已知:途径Ⅰ、Ⅱ、Ⅲ中均有空气参与;硫酸的结构为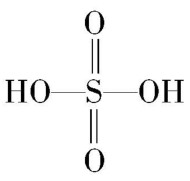 。下列说法错误的是( )
。下列说法错误的是( )
A. 含硫矿物粉碎有利于提高煅烧效率
B. 途径Ⅱ发生的反应为 $ {\rm 2{\mathrm{C}\mathrm{a}\mathrm{C}\mathrm{O}}_{3}+{\mathrm{O}}_{2}+2{\mathrm{S}\mathrm{O}}_{2}\xlongequal{高温}2{\mathrm{C}\mathrm{a}\mathrm{S}\mathrm{O}}_{4}+2{\mathrm{C}\mathrm{O}}_{2}} $
C. 途径Ⅲ产生的 $ {\rm {\mathrm{S}\mathrm{O}}_{3}} $ 用 $ 98.3\% $ 的浓硫酸吸收制得硫酸
D. 流程中的含硫化合物所含 $ {\rm \mathrm{S}} $ 元素的化合价均不同
答案:D
解析:含硫矿物粉碎能增大反应物间的接触面积,有利于提高煅烧效率, $ {\rm \mathrm{A}} $ 正确;高温条件下, $ {\rm {\mathrm{C}\mathrm{a}\mathrm{C}\mathrm{O}}_{3}} $ 、 $ {\rm {\mathrm{O}}_{2}} $ 和 $ {\rm {\mathrm{S}\mathrm{O}}_{2}} $ 反应生成 $ {\rm {\mathrm{C}\mathrm{a}\mathrm{S}\mathrm{O}}_{4}} $ 和 $ {\rm {\mathrm{C}\mathrm{O}}_{2}} $ ,反应方程式为 $ {\rm 2{\mathrm{C}\mathrm{a}\mathrm{C}\mathrm{O}}_{3}+{\mathrm{O}}_{2}+2{\mathrm{S}\mathrm{O}}_{2}\xlongequal{高温}2{\mathrm{C}\mathrm{a}\mathrm{S}\mathrm{O}}_{4}+2{\mathrm{C}\mathrm{O}}_{2}} $ , $ {\rm \mathrm{B}} $ 正确;用水吸收 $ {\rm {\mathrm{S}\mathrm{O}}_{3}} $ 会放出大量的热,产生酸雾,所以工业上用 $ 98.3\% $ 的浓硫酸吸收途径Ⅲ产生的 $ {\rm {\mathrm{S}\mathrm{O}}_{3}} $ 得到 $ {\rm {\mathrm{H}}_{2}{\mathrm{S}\mathrm{O}}_{4}} $ , $ {\rm \mathrm{C}} $ 正确;流程中 $ {\rm {\mathrm{S}\mathrm{O}}_{3}} $ 、 $ {\rm {\mathrm{C}\mathrm{a}\mathrm{S}\mathrm{O}}_{4}} $ 与 $ {\rm {\mathrm{C}\mathrm{H}}_{3}{\mathrm{O}\mathrm{S}\mathrm{O}}_{3}\mathrm{H}} $ 中 $ {\rm \mathrm{S}} $ 的化合价都是 $ +6 $ , $ {\rm \mathrm{D}} $ 错误。
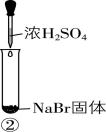
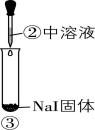
7.某小组同学为探究浓硫酸的性质,向试管①②中加入等量的 $ 98\% $ 的浓硫酸,进行如下实验。
| 实验1 | 实验2 | 实验3 |
装置 | 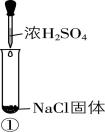
| 
| 
|
现象 | 溶液颜色无明显变化;把蘸有浓氨水的玻璃棒靠近试管口,产生白烟 | 溶液变黄;把湿润的品红试纸靠近试管口,试纸褪色 | 溶液变深紫色(经检验溶液含碘单质) |
下列对实验的分析不合理的是( )
A. 实验1中有挥发性物质生成
B. 根据实验1和实验2判断还原性: $ {\rm {\mathrm{B}\mathrm{r}}^{-} > {\mathrm{C}\mathrm{l}}^{-}} $
C. 根据实验3判断还原性: $ {\rm {\mathrm{I}}^{-} > {\mathrm{B}\mathrm{r}}^{-}} $
D. 可用浓 $ {\rm {\mathrm{H}}_{2}{\mathrm{S}\mathrm{O}}_{4}} $ 干燥 $ {\rm \mathrm{H}\mathrm{C}\mathrm{l}} $ 气体,但不能干燥 $ {\rm \mathrm{H}\mathrm{I}} $ 气体
答案:C
解析:由思路导引知,实验1中有挥发性物质 $ {\rm \mathrm{H}\mathrm{C}\mathrm{l}} $ 产生, $ {\rm \mathrm{A}} $ 合理;实验1中溶液颜色无明显变化,说明浓硫酸不能氧化氯离子,实验2中溶液变黄说明相同条件下浓硫酸能氧化溴离子,所以还原性: $ {\rm {\mathrm{B}\mathrm{r}}^{-} > {\mathrm{C}\mathrm{l}}^{-}} $ , $ {\rm \mathrm{B}} $ 合理;若②中溶液含有过量浓硫酸,则可能是浓硫酸把碘离子氧化为碘单质,不能得出还原性: $ {\rm {\mathrm{I}}^{-} > {\mathrm{B}\mathrm{r}}^{-}} $ , $ {\rm \mathrm{C}} $ 不合理;浓硫酸不能氧化氯离子,还原性: $ {\rm {\mathrm{I}}^{-} > {\mathrm{B}\mathrm{r}}^{-} > {\mathrm{C}\mathrm{l}}^{-}} $ ,浓硫酸能把溴离子氧化为溴单质,则浓硫酸也可将 $ {\rm {\mathrm{I}}^{-}} $ 氧化为 $ {\rm {\mathrm{I}}_{2}} $ ,故可用浓 $ {\rm {\mathrm{H}}_{2}{\mathrm{S}\mathrm{O}}_{4}} $ 干燥 $ {\rm \mathrm{H}\mathrm{C}\mathrm{l}} $ 气体,但不能干燥 $ {\rm \mathrm{H}\mathrm{I}} $ 气体, $ {\rm \mathrm{D}} $ 合理。
8.硫化氢的转化是资源利用和环境保护的重要研究课题。将 $ {\rm {\mathrm{H}}_{2}\mathrm{S}} $ 和 $ {\rm {\mathrm{O}}_{2}} $ 的混合气体通入 $ {\rm {\mathrm{F}\mathrm{e}\mathrm{C}\mathrm{l}}_{3}} $ 、 $ {\rm {\mathrm{F}\mathrm{e}\mathrm{C}\mathrm{l}}_{2}} $ 和 $ {\rm {\mathrm{C}\mathrm{u}\mathrm{C}\mathrm{l}}_{2}} $ 的混合溶液中回收 $ {\rm \mathrm{S}} $ ,其转化如图所示。下列说法不正确的是( )
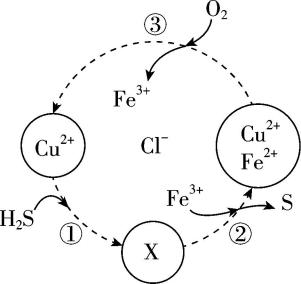
A. 图示转化中化合价不变的元素只有铜, $ {\rm \mathrm{X}} $ 是 $ {\rm \mathrm{C}\mathrm{u}\mathrm{S}} $
B. 过程②中,每生成 $ {\rm 1\mathrm{m}\mathrm{o}\mathrm{l}\mathrm{S}} $ ,转移 $ 2\mathrm{m}\mathrm{o}\mathrm{l} $ 电子
C. 该过程的总反应为 $ {\rm 2{\mathrm{H}}_{2}\mathrm{S}+{\mathrm{O}}_{2}\xlongequal{催化剂}2{\mathrm{H}}_{2}\mathrm{O}+2\mathrm{S}↓} $
D. 在转化过程中能循环利用的物质有 $ {\rm {\mathrm{F}\mathrm{e}\mathrm{C}\mathrm{l}}_{3}} $ 、 $ {\rm {\mathrm{C}\mathrm{u}\mathrm{C}\mathrm{l}}_{2}} $
答案:A
解析:根据题图,转化过程中,化合价不变的元素有 $ {\rm \mathrm{C}\mathrm{u}} $ 、 $ {\rm \mathrm{C}\mathrm{l}} $ 、 $ {\rm \mathrm{H}} $ , $ {\rm \mathrm{A}} $ 错误;过程②发生的反应为 $ {\rm \mathrm{C}\mathrm{u}\mathrm{S}+2{\mathrm{F}\mathrm{e}}^{3+}\xlongequal{}{\mathrm{C}\mathrm{u}}^{2+}+\mathrm{S}+2{\mathrm{F}\mathrm{e}}^{2+}} $ ,每生成 $ {\rm 1\mathrm{m}\mathrm{o}\mathrm{l}\mathrm{S}} $ ,转移 $ 2\mathrm{m}\mathrm{o}\mathrm{l} $ 电子, $ {\rm \mathrm{B}} $ 正确;根据题图可知,该过程为 $ {\rm {\mathrm{H}}_{2}\mathrm{S}} $ 和 $ {\rm {\mathrm{O}}_{2}} $ 在催化剂作用下生成硫和水,即总反应为 $ {\rm 2{\mathrm{H}}_{2}\mathrm{S}+{\mathrm{O}}_{2}\xlongequal{催化剂}2{\mathrm{H}}_{2}\mathrm{O}+2\mathrm{S}↓} $ , $ {\rm \mathrm{C}} $ 正确;根据题图,在转化过程中能循环利用的物质有 $ {\rm {\mathrm{F}\mathrm{e}\mathrm{C}\mathrm{l}}_{3}} $ 、 $ {\rm {\mathrm{C}\mathrm{u}\mathrm{C}\mathrm{l}}_{2}} $ , $ {\rm \mathrm{D}} $ 正确。
9.实验、类比、推理是化学学习的重要方法。某课外活动小组根据 $ {\rm \mathrm{M}\mathrm{g}} $ 与 $ {\rm {\mathrm{C}\mathrm{O}}_{2}} $ 的反应,用图甲所示装置探究 $ {\rm \mathrm{M}\mathrm{g}} $ 与 $ {\rm {\mathrm{S}\mathrm{O}}_{2}} $ 的反应,并探究其产物成分。
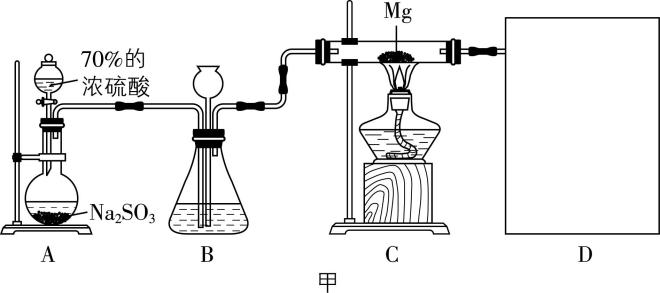
(1) 写出装置A中制备 $ {\rm {\mathrm{S}\mathrm{O}}_{2}} $ 的化学方程式: 。
(2) 装置B的作用之一是观察 $ {\rm {\mathrm{S}\mathrm{O}}_{2}} $ 的生成速率,为保证实验的严谨性,其中的液体最好选择 (填序号)。
$ \mathrm{a} $ .饱和 $ {\rm {\mathrm{N}\mathrm{a}\mathrm{H}\mathrm{C}\mathrm{O}}_{3}} $ 溶液 $ \mathrm{b} $ .饱和 $ {\rm {\mathrm{N}\mathrm{a}}_{2}{\mathrm{S}\mathrm{O}}_{3}} $ 溶液
$ \mathrm{c} $ .饱和 $ {\rm {\mathrm{N}\mathrm{a}\mathrm{H}\mathrm{S}\mathrm{O}}_{3}} $ 溶液 $ \mathrm{d} $ .浓硫酸
(3) 补充装置D中的装置图并注明装置内选用的试剂。
(4) 依据 $ {\rm \mathrm{M}\mathrm{g}} $ 与 $ {\rm {\mathrm{C}\mathrm{O}}_{2}} $ 的反应,三位同学对 $ {\rm \mathrm{M}\mathrm{g}} $ 与 $ {\rm {\mathrm{S}\mathrm{O}}_{2}} $ 反应的产物提出不同假设,并将装置C中玻璃管内的固体产物加入图乙所示装置 $ \mathrm{a} $ 中的大试管内,进一步设计实验探究 $ {\rm \mathrm{M}\mathrm{g}} $ 与 $ {\rm {\mathrm{S}\mathrm{O}}_{2}} $ 反应的产物,若固体产物只有两种,依据充分反应后的现象,完成下列表格:
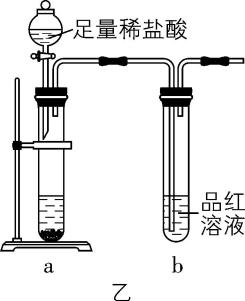
假设 | $ \mathrm{a} $ 中现象 | $ \mathrm{b} $ 中现象 |
① 和 $ {\rm \mathrm{S}} $ | 固体不完全溶解,无气泡产生 | 溶液不褪色 |
② 和 $ {\rm \mathrm{S}} $ | 固体不完全溶解,且有气泡产生 | 溶液褪色 |
$ {\rm ③\mathrm{M}\mathrm{g}\mathrm{O}} $ 和 $ {\rm \mathrm{M}\mathrm{g}\mathrm{S}} $ | 固体完全溶解,且有气泡产生 | |
答案:(1) $ {\rm {\mathrm{H}}_{2}{\mathrm{S}\mathrm{O}}_{4}(浓)+{\mathrm{N}\mathrm{a}}_{2}{\mathrm{S}\mathrm{O}}_{3}\xlongequal{}{\mathrm{N}\mathrm{a}}_{2}{\mathrm{S}\mathrm{O}}_{4}+{\mathrm{S}\mathrm{O}}_{2}↑+{\mathrm{H}}_{2}\mathrm{O}} $
(2) $ \mathrm{d} $
(3) 
(4) $ {\rm \mathrm{M}\mathrm{g}\mathrm{O}} $ ; $ {\rm {\mathrm{M}\mathrm{g}\mathrm{S}\mathrm{O}}_{3}} $ ;溶液不褪色
解析:9.装置 $ {\rm \mathrm{A}} $ 中制备二氧化硫气体, $ {\rm {\mathrm{S}\mathrm{O}}_{2}} $ 经装置 $ {\rm \mathrm{B}} $ 干燥后进入装置 $ {\rm \mathrm{C}} $ 中与镁发生反应,该反应要防止水、二氧化碳的干扰,因此装置 $ {\rm \mathrm{D}} $ 中装有碱石灰,既能吸收未反应的二氧化硫,防止污染空气,又能防止空气中的水蒸气和二氧化碳进入装置 $ {\rm \mathrm{C}} $ 。
(1) 装置 $ {\rm \mathrm{A}} $ 中浓硫酸与亚硫酸钠反应制取 $ {\rm {\mathrm{S}\mathrm{O}}_{2}} $ ,化学方程式为 $ {\rm {\mathrm{H}}_{2}{\mathrm{S}\mathrm{O}}_{4}(浓)+{\mathrm{N}\mathrm{a}}_{2}{\mathrm{S}\mathrm{O}}_{3}\xlongequal{}{\mathrm{N}\mathrm{a}}_{2}{\mathrm{S}\mathrm{O}}_{4}+{\mathrm{S}\mathrm{O}}_{2}↑+{\mathrm{H}}_{2}\mathrm{O}} $ 。
(2) 进入装置 $ {\rm \mathrm{C}} $ 的二氧化硫必须纯净干燥,只有浓硫酸具有吸水性,且不与二氧化硫反应,故装置 $ {\rm \mathrm{B}} $ 中的液体最好选择浓硫酸。
(3) 根据分析可知,装置 $ {\rm \mathrm{D}} $ 中的试剂为碱石灰,装置图见答案。
(4) 依据 $ {\rm \mathrm{M}\mathrm{g}} $ 与 $ {\rm {\mathrm{C}\mathrm{O}}_{2}} $ 的反应: $ {\rm 2\mathrm{M}\mathrm{g}+{\mathrm{C}\mathrm{O}}_{2}\xlongequal{点燃}2\mathrm{M}\mathrm{g}\mathrm{O}+\mathrm{C}} $ ,推测 $ {\rm \mathrm{M}\mathrm{g}} $ 与 $ {\rm {\mathrm{S}\mathrm{O}}_{2}} $ 反应的产物。固体产物只有两种,则可能为 $ {\rm \mathrm{M}\mathrm{g}\mathrm{O}} $ 和 $ {\rm \mathrm{S}} $ ,氧化镁与盐酸反应生成氯化镁和水,硫不与盐酸反应,也不溶于盐酸,因此加盐酸的实验现象为固体不完全溶解,无气泡产生, $ \mathrm{b} $ 中溶液不褪色,即假设①;氧化镁是碱性氧化物,二氧化硫是酸性氧化物,加热时两者能反应生成亚硫酸镁,则固体产物也可能为 $ {\rm {\mathrm{M}\mathrm{g}\mathrm{S}\mathrm{O}}_{3}} $ 和 $ {\rm \mathrm{S}} $ , $ {\rm {\mathrm{M}\mathrm{g}\mathrm{S}\mathrm{O}}_{3}} $ 与盐酸反应生成氯化镁、二氧化硫和水,硫不与盐酸反应,也不溶于盐酸,因此加盐酸的实验现象为固体不完全溶解,有气泡产生,气体能使品红溶液褪色,即假设②;金属镁和非金属单质硫可反应生成硫化镁,则固体产物可能为 $ {\rm \mathrm{M}\mathrm{g}\mathrm{O}} $ 和 $ {\rm \mathrm{M}\mathrm{g}\mathrm{S}} $ ,硫化镁能和盐酸反应生成氯化镁和硫化氢气体,固体加盐酸的实验现象为固体完全溶解,有气泡产生,气体不能使品红溶液褪色,即假设③。

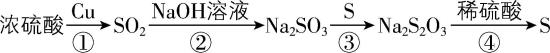





 。下列说法错误的是( )
。下列说法错误的是( )

